Analyses élémentaires et isotopiques des otolithes
Apprenez à analyser les otolithes à l’aide de techniques d’analyse élémentaire et isotopique.
Sur cette page
Décontamination

Hotte inversée utilisée pour empêcher la poussière et les contaminants d’entrer dans les échantillons.
Lorsque vous manipulez des otolithes destinés aux analyses élémentaires ou isotopiques, vous devez les nettoyer et les protéger d’une éventuelle contamination. Voici un protocole simplifié :
- retirer les 2 otolithes sagittaux du poisson immédiatement après sa capture
- ou congeler le poisson, mais ne pas le conserver dans un liquide de conservation
- retirer immédiatement tous les tissus adhérents à la surface des otolithes après l’extraction de ces derniers
- à cette étape, cela peut se faire avec les doigts ou une pince en métal
- décontaminer les otolithes en les soumettant aux ultrasons à plusieurs reprises dans des flacons en polyéthylène lavés à l’acide contenant de l’eau distillée, désionisée et soumise à une osmose inverse (eau Super-Q ou Milli-Q)
- il est possible de retirer les tissus restant à la surface des otolithes en les nettoyant sous un jet d’eau Super-Q à l’aide d’une brosse à dents de nylon lavée à l’acide avant le traitement aux ultrasons.
- à cette étape et aux étapes suivantes, toutes les manipulations doivent être effectuées à l’aide d’outils non métalliques lavés à l’acide (à l’exception des dosages du radiocarbone)
- sécher les otolithes décontaminés dans une hotte à flux laminaire à pression positive (classe 100)
- conserver les échantillons dans des flacons secs en polyéthylène lavés à l’acide
- les flacons sont plus faciles à utiliser et le risque de perdre des petits morceaux en les ouvrant est moindre
- l’entreposage dans du papier d’aluminium est approprié pour les échantillons destinés aux dosages du radiocarbone
Préparation du matériel en plastique
Préparer tout nouvel équipement en plastique, comme les flacons, les bouchons et les pinces :
- rincer dans de l’éthanol à 95 % puis dans de l’eau Super-Q
- sécher à l’air dans une chambre à pression positive
- emballer dans des sacs en plastique avant le lavage à l’acide
Effectuer les opérations de lavage à l’acide sous une hotte. Porter des gants en caoutchouc résistant à l’acide et utiliser des pinces antiadhésives pour manipuler le matériel. Le bain d’acide est fait de polyéthylène haute densité réticulé et reste couvert avant et pendant l’immersion. Les bassins d’eau sont aussi en polyéthylène haute densité réticulé ou en polyéthylène haute densité.
Avant d’être décontaminé, le matériel est :
- immergé pendant au moins 8 heures dans de l’acide chlorhydrique 6N pour l’analyse de métaux à l’état de traces
- rincé 3 fois dans de l’eau Super-Q
- plongé pendant 4 heures (laisser reposer puis rincer) dans de l’eau Super-Q
- rincé 3 fois dans de l’eau Super-Q
- entreposé dans des sacs en plastique hermétiques
Une fois cette étape terminée, le matériel lavé à l’acide est placé dans une hotte pour y être séché à l’air, puis remballé dans des sacs en plastique hermétiques avant d’être utilisé.
L’acide chlorhydrique 12N est dilué dans de l’eau Super-Q selon un rapport de 1 pour 1 afin d’obtenir l’acide 6N nécessaire. L’acide est ajouté à l’eau. Effectuez cette étape sous une hotte.
Décontamination et manipulation des otolithes
Au cours de la décontamination, les otolithes sont manipulés à l’aide de gants en plastique. Les otolithes ne doivent entrer en contact qu’avec des produits chimiques ultra-propres et des équipements ou instruments fait de matière antiadhésive, polyéthylène et polypropylène
Placez chaque otolithe dans de l’eau Super-Q à l’intérieur d’un flacon conique de 50 ml étiqueté et lavé à l’acide. Soumettez-le ensuite aux ultrasons pendant 5 minutes dans un appareil de nettoyage à ultrasons. Regrouper 5 flacons à la fois (retenus par un élastique) dans l’appareil à ultrasons.
Après le premier traitement aux ultrasons, frotter chaque otolithe sous un filet d’eau Super-Q à l’aide d’une brosse à dents lavée à l’acide pendant 1 minute pour enlever toute particule ou membrane adhérant à sa surface.
Rincer ensuite chaque otolithe à 3 reprises dans de l’eau Super-Q et le remettre dans son flacon lavé à l’acide rempli d’eau fraîche du même type. Soumettre chaque otolithe aux ultrasons pendant 3 minutes (5 flacons à la fois) puis rincer à 3 reprises avec de l’eau Super-Q.
Enfin, sécher les otolithes à l’air dans le bouchon du flacon dans la chambre à pression pendant 18 à 24 heures. Les conserver ensuite dans leurs flacons respectifs fermés hermétiquement. Vous pouvez réutiliser les flacons coniques de 50 ml pour 4 autres décontaminations s’ils ne doivent pas servir à la digestion.
Balance et pesage
Peser les flacons contenant les otolithes un à la fois.
Réduire au minimum le temps d’exposition des otolithes à l’air ambiant. Transférer rapidement chacun d’entre eux dans un bouchon de flacon lavé à l’acide conservé à l’intérieur de la balance (tarée avant la pesée). Pendant cette opération, garder le flacon fermé. Toujours manipuler les otolithes avec des pinces et des gants en plastique.
Digestion
Si la digestion des otolithes doit avoir lieu dans leur flacon conique de 50 ml, vous pouvez les y conserver secs jusqu’à ce moment-là. Si ce n’est pas le cas, ils peuvent être conservés dans des flacons de 2,5 ml en plastique, lavés à l’acide, étiquetés et fermés hermétiquement (flacons de 5 ml pour les gros otolithes). Placer tous les flacons à l’intérieur de la hotte dans des portoirs couverts d’une feuille de plastique ou dans des sacs en plastique hermétiques lavés à l’acide.
Flacons pour la décontamination et la digestion
Nous utilisons des flacons coniques en polypropylène de 50 ml pour la décontamination et la digestion acide des otolithes.
Pour le lavage à l’acide, nous achetons l’acide chlorhydrique 12N dosé pour l’analyse de métaux traces et le diluons à 50 % dans de l’eau Super-Q. Faire tremper les nouveaux flacons (avant le lavage à l’acide) dans de l’éthanol non dénaturé à 95 %.
Gants
Utiliser des gants jetables en polyéthylène pour manipuler les otolithes et les flacons. Vous n’avez pas besoin de laver vos gants à l’acide avant de les utiliser. Ne pas utiliser de gants chirurgicaux. Ils contiennent souvent une poudre pour accroître leur confort, mais cette poudre peut contaminer vos analyses.
Analyse élémentaire
Une fois les otolithes décontaminés, vous pouvez les analyser pour en déterminer la composition élémentaire. Pour cela, vous devez préparer les otolithes.
Digestion
Effectuer la digestion dans des flacons de polypropylène prénettoyés (lavés à l’acide), tels que des tubes de centrifugeuse à bord évasé de 30 ml en polypropylène. D’autres flacons peuvent être utilisés, mais ils doivent être munis d’un bouchon à vis non pigmenté sans bague de déversement.
Les otolithes de 100 à 500 mg sont digérés pendant plusieurs heures dans 2 ml d’une solution composée à parts égales :
- d’eau Super-Q, qui est de l’eau qui a été :
- distillée
- désionisée
- soumise à une osmose inverse
- et d’acide nitrique de grande pureté (Seastar)
Conserver les otolithes dans les contenants d’origine des échantillons et les chauffer pendant 15 minutes à une température de 50 à 60 degrés Celsius pour terminer la digestion.
Pour digérer entièrement les plus gros otolithes, ajouter de 0,5 à 1,0 ml d’acide.
Diluer les solutions finales avec de l’eau Super-Q pour obtenir un volume final de 30 ml. Diluer à nouveau les solutions avec de l’eau du même type selon un rapport de 1 pour 10, afin d’obtenir une concentration finale d’environ 0,1 % M/V. Du rhodium est parfois ajouté comme étalon interne pour surveiller les variations de l’efficacité de la nébulisation. Puisque nous analysons la plupart des éléments par dilution isotopique, du Cr-52 est ajouté comme étalon interne pour le Mn. Des isotopes enrichis pour l’analyse par dilution isotopique à l’aide d’un spectromètre de masse à plasma inductif sont ajoutés à cette étape. Tous les flacons ont reçu la même quantité d’isotopes enrichis.
Essai à blanc de méthode
Exécuter un essai à blanc complet de la méthode, qui comprend tout le matériel et les réactifs utilisés dans l’analyse, y compris :
- l’eau
- les acides
- les tubes jaugés
- les embouts de pipette
- les flacons d’échantillon
- la brosse à dents utilisée pour nettoyer les spécimens
- la pellicule plastique (peut servir à couvrir les échantillons)
Utiliser des solutions étalons acides diluées simples pour l’étalonnage initial des instruments, mais des étalons à teneur élevée en calcium sont utilisés pour surveiller (et corriger) les interférences dues à l’ionisation et pour compenser la dérive des instruments.
Préparer et analyser les échantillons en lots séparés de 2 ou 3 blancs de réactifs. Traiter chaque groupe d’échantillons.
Préparer un échantillon composé d’environ 20 otolithes et étudier des portions de cette solution principale dans chaque lot d’analyse. Analyser également un autre échantillon composé d’otolithes provenant d’une étude antérieure. Ce ne sont pas des étalons, mais ils permettent de surveiller la précision à l’intérieur des lots et entre lots d’études différentes.
Pour s’assurer que les effets séquentiels n’affectent pas un groupe particulier d’échantillons :
- fournir des échantillons constitués de groupes en fonction du lieu d’échantillonnage
- répartir aléatoirement les échantillons dans chaque groupe
- répartir chaque groupe dans les lots de préparation
- répartir aléatoirement les échantillons dans chaque lot de préparation
Techniques de microéchantillonnage
Utiliser des techniques de microéchantillonnage pour extraire mécaniquement une partie de l’otolithe en vue d’une analyse ultérieure. Vous pouvez extraire les parties sous forme de poudre, prélevée à une profondeur donnée (anneaux de croissance annuels) ou sous forme de noyau (première année de croissance).
Les dosages du radiocarbone issu des essais nucléaires et les essais de détermination des rapports des isotopes stables sont des exemples d’applications qui nécessitent l’analyse de certaines parties d’otolithes en particulier (selon les âges ou les dates). Pour ces applications, les meilleures procédures d’échantillonnage sont des techniques de microéchantillonnage ou de carottage d’otolithes qui permettent d’en extraire des parties précises.
Système automatisé de microéchantillonnage
Notre système de microéchantillonnage MicroMill comprend un :
- ordinateur personnel doté d’un microprocesseur Pentium, du logiciel MicroMill, d’une carte vidéo Coreco Bandit et de logiciels pilotes
- moniteur de 17 pouces dont la résolution maximale est de 1280 x 1024 pixels
- échantillonneur MicroMill, composé d’un stéréomicroscope Leica équipé :
- d’une caméra vidéo couleur à haute résolution
- d’une platine XYZ motorisée à haute résolution (0,25 µm)
- d’un mandrin de meulage à couple élevé et à vitesse réglable
- de mèches de meulage à pointe de carbure ou en acier au cobalt trempé
Ce système permet d’effectuer un microéchantillonnage automatisé et précis grâce à la numérisation à l’écran de la zone échantillonnée et à un contrôle précis de la profondeur.
Habituellement, nous utilisons la mèche pour découper des morceaux de l’otolithe, qui sont décontaminés avant l’analyse.
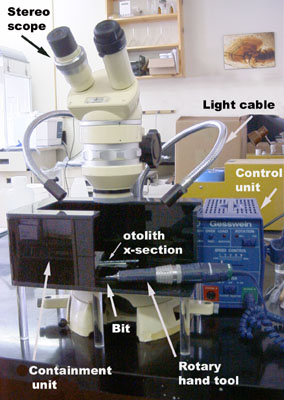
Perceuse portative
Notre système d’échantillonnage portatif comprend :
- une unité de commande et un outil rotatif (Power Hand 2X Z-55X), à vitesse de rotation maximale de 55 000 tr/min, fabriqués par Gesswein
- un jeu de mèches comprenant une mèche à pointe arrondie à diamant et des outils de coupe circulaire
- un stéréomicroscope Wild
- un illuminateur à fibre optique de haute intensité muni de 2 câbles à col de cygne
- un bac en acrylique pour éviter de perdre l’échantillon
- un aspirateur muni d’un filtre à haute efficacité HEPA pour éliminer les particules fines de poussière de l’aire de travail
Ce système portatif, qui fait appel à une combinaison de techniques de perçage et de sculpture, constitue une solution de rechange abordable au système MicroMill automatisé. Cependant, son utilisation exige beaucoup de temps et son abordabilité ne compense pas son manque de précision.
Analyse statistique
La capacité d’utiliser les empreintes digitales élémentaires pour distinguer les espèces de stocks mixtes de différentes sources a augmenté la demande d’un logiciel statistique qui puisse séparer les groupes mixtes.
L’analyse discriminante ne convient pas ici, car les paramètres des éléments « antérieurs » sont inconnus. Nous publions ici des travaux en cours portant sur 2 méthodes de séparation des stocks mixtes à partir de leurs empreintes élémentaires ou d’autres variables continues ou catégoriques.
Analyse bayésienne des mélanges de stock
L’analyse bayésienne des mélanges de stocks (mix.Fish) permet l’analyse simultanée de données continues (élémentaires) et catégoriques (génétiques, méristiques).
Le progiciel R mix.Fish (fichier ZIP, 46 Ko) contient un ensemble de données en échantillon et a été écrit pour R 3.0.1. Une version Mix.Fish pour Unix (fichier ZIP, 22 Ko) est également disponible. Une notice d’installation (DOC, 30 Ko) est fournie.
Analyse intégrée des mélanges de stocks
Le programme d’analyse intégrée des mélanges de stocks (ISMA) (écrit pour l’environnement S-Plus) est une méthode basée sur la vraisemblance maximale pour analyser un mélange inconnu de stocks en fonction de groupes connus (de référence).
- Télécharger la fonction ISMA et le fichier d’accompagnement (fichier ZIP, 4 Ko)
Pour lire la fonction dans votre session S-Plus, utiliser vos chemins d’accès appropriés et saisir : source(“d:\assess\scaling\ISMA.ssc”).
Analyse discriminante
Quelle que soit la méthode d’analyse de groupes mixtes utilisée, elle n’indiquera pas les différences éventuelles des groupes de référence.
Pour cela, vous avez besoin d’une analyse de variance à plusieurs variables ou d’une analyse discriminante. Plus vos groupes de référence sont différenciés (en fonction des variables employées), plus la classification des composantes inconnues d’un stock est précise.
- Date de modification :