Fiche Technique du Programme Coopératif de Recherche et Développement en Aquaculture (PCRDA)
Numéro 21 - Décembre, 2013
Résumé
Les exploitations aquacoles de saumon de l'Atlantique ont besoin d'une méthode pour lutter contre les infestations du pou du poisson (Lepeophtheirus salmonis). Une des méthodes pour lutter contre ce parasite est l’utilisation du SLICE®, dont la matière active est le benzoate d'émamectine (BE), un composé synthétique administré oralement en le mélangeant à la nourriture et étant absorbé par le tube digestif, d'où il passe aux tissus. Santé Canada (SC) et l’Agence canadienne d’inspection des aliments (ACIA) ont établi des lignes directrices pour l'utilisation de ce produit en ce qui concerne la limite maximale de résidus (LMR) et le délai d'attente. Toutefois, ces lignes directrices ont été jugées trop rigoureuses par rapport aux critères des autres administrations nationales car elles imposaient des restrictions aux producteurs en ce qui concerne les activités de récolte, planifiées et d'urgence, faisant inutilement obstacle à la commercialisation. Pour étudier le taux d'élimination du benzoate d'émamectine par rapport au délai d’attente, on s'est penché sur le taux d'élimination des résidus de SLICE® des tissus du saumon de l’Atlantique (Salmo salar) en laboratoire et dans les exploitations commerciales. En laboratoire et sur le terrain, on a administré une dose quotidienne de SLICE® de 50 microgramme par kilogramme (μg / kg) de poids corporel pendant 7 jours consécutifs. On a surveillé l'élimination du composé des tissus de 1 à 45 jours après le traitement. Dans les échantillons de laboratoire, la teneur de résidus de BE dans le tissu musculaire se situait entre 7,3 et 60,5 nanogramme par gramme (ng / g) et entre 28,1 et 199,7 ng / g dans le tissu cutané. Au moment de l'étude, la LMR autorisée par SC et l'ACIA était de 100 et 1 000 ng / g respectivement dans le tissu musculaire et le tissu cutané. Des teneurs de cet ordre n'ont pas été détectées ni sur le terrain ni en laboratoire, ce qui indique que la concentration réelle des résidus de BE n'a pas dépassé les limites établies. Les résultats de ce projet ont joué un rôle fondamental dans l’obtention de l'approbation et de l'homologation du SLICE®, en 2009 auprès de Santé Canada, qui a par ailleurs ramené le délai d’attente à 0 jour.
Le Programme coopératif de recherche et développement en aquaculture (PCRDA) est une initiative concertée de Pêches et Océans Canada et de l'industrie de l'aquaculture visant à stimuler la recherche et le développement. Les projets menés dans le cadre du PCRDA visent l'amélioration du rendement environnemental de l'aquaculture et servent à préserver la santé optimale des poissons.
Introduction
La matière active de SLICE®, le benzoate d'émamectine (BE), est un composé semi-synthétique utilisé dans les exploitations salmonicoles pour combattre le pou du poisson (Lepeophtheirus salmonis). Une fois administré oralement, le composé est absorbé dans le tube digestif et métabolisé avant d’être excrété à la peau et au mucus où son efficacité pour lutter contre les infestations par le pou du poisson se prolonge pendant 10 semaines. La dose de BE recommandée par le fabricant est de 50 µg / kg par jour pendant 7 jours consécutifs. Le composé agit comme bloqueur neuronal sur le pou du poisson, il cause la paralysie avant de provoquer la mort. Il est essentiel de combattre le pou du poisson dans les exploitations aquacoles, car les populations du parasite peuvent se multiplier rapidement et entraîner de graves répercussions économiques pour l'exploitation.
L'utilisation de SLICE® a été soumise à l'approbation de Santé Canada en 1999, et le produit a été homologué au Canada à la fin de l’année 2009. Pendant la période d'homologation, la Direction des médicaments vétérinaires (DMV) de Santé Canada (SC), dans le cadre du Programme de distribution de médicaments d'urgence, s'est chargée d'approuver l'utilisation d'urgence du produit au cas par cas. Les lignes directrices ont établi une limite maximale de résidus (LMR) de 42 ng / g, pour des températures de l'eau de 5 °C ou plus, et elles ont interdit la récolte du saumon pour la chaîne alimentaire pendant 68 jours après le dernier traitement de SLICE®. La plupart des administrations internationales gérant l'aquaculture ont imposé des restrictions semblables, mais avec des LMR plus élevées (p. ex., 100 ng / g) et des délais d’attente plus courts (p. ex., 0 jour au Royaume-Uni et au Chili, et 7 jours en Norvège). Le long délai d’attente au Canada fait obstacle à la commercialisation du saumon qui a été traité au SLICE® au cours des 68 jours précédents.
Santé Canada et l'Agence canadienne d'inspection des aliments (ACIA) ont accepté de réexaminer les lignes directrices concernant la LMR et les délais d'attente si on pouvait fournir des données concluantes concernant l'évolution des résidus de BE dans le temps pour mieux orienter la prise de décisions.
Dans la présente étude, on a eu recours à des travaux en laboratoire et sur le terrain afin de combler des lacunes dans les connaissances sur l'élimination des résidus de BE des tissus du saumon de l'Atlantique (Salmo salar) (figure 1). Pour l'étude, on a maintenu une température de l'eau comparable à celle de l'eau de mer lors des infestations de pou du poisson et des traitements au SLICE®. Le principal objectif de l'étude était de calculer la courbe d'élimination de résidus de BE du saumon de l’Atlantique d'élevage afin d'orienter les décisions de SC et de l'ACIA concernant la modification des LMR et des délais d'attente.

Site aquacole

Figure 1 Saumon de l'Atlantique d'élevage (Salmo salar)
Méthodes
Logistique générale
Pour la partie de l'étude en laboratoire, on s'est servi des viviers de la station de recherche marine de Sandy Cove, en Nouvelle-Écosse. Pendant et après le traitement, les réservoirs expérimentaux étaient alimentés, en circuit ouvert, d'eau de mer à température contrôlée. La température de l'eau était de 10,08 ± 0,26 °C; la salinité, de 32 à 35 gramme par litre (g / l) et la teneur en oxygène dissous, de 10,7 ± 1,2 mg / l; et, le débit d'alimentation était de 37 l / min. Pour la partie de l'étude sur le terrain, on a recueilli des échantillons à partir de sites marins d'élevage en cage ayant été traités au SLICE®. Contrairement aux essais en laboratoire, les échantillons prélevés sur le terrain correspondaient à des saumons exposés aux conditions ambiantes (c.-à-d., température, salinité, etc.).
La nourriture pour saumons utilisée dans les essais en laboratoire provenait de plusieurs fournisseurs, en fonction des essais; les saumons de l'essai à dose unique ont été nourris avec la nourriture Signature Salmon Ration uniquement (Northeast Nutrition Inc.). Intervet Schering Plough a directement fourni aux fabriques de nourriture les instructions sur le mélange et le contrôle de la qualité du benzoate d'émamectine. Cantest Ltd. (C.-B.) a confirmé les concentrations nominales de BE dans les aliments médicamenteux, lesquelles ont servi à déterminer le taux d’alimentation quotidien nécessaire pour obtenir une dose de 50 µg / kg pendant 7 jours d'alimentation. On a également fait tester les concentrations de BE par deux autres laboratoires pour confirmer les doses.
Plan expérimental en laboratoire
On a effectué plusieurs essais en laboratoire au cours de ce projet. L'essai à dose unique consistait à administrer au saumon de l’Atlantique la dose de BE recommandée par le fabricant et de prélever des tissus à plusieurs reprises après l'administration de la nourriture médicamentée afin de déterminer la teneur en résidus de BE contenue dans les tissus. Un résumé plus complet de cette étude est décrit par Whyte et al. (2011).
En fonction de leur poids, on a réparti les poissons en 7 groupes de 28 poissons pour obtenir des groupes présentant une biomasse uniforme. On a utilisé 21 poissons supplémentaires comme témoin. Avant de commencer l'expérience, on a marqué les poissons avec des étiquettes à code de couleur sur la partie ventrale à la nageoire dorsale pour indiquer le groupe de traitement et la période d’échantillonnage (jours 1, 3, 5, 10, 15, 30 et 45). Par ailleurs, on a choisi 4 poissons au hasard parmi les différents groupes afin de servir de poissons de référence; ils ont été sacrifiés pour prélever des tissus avant le début du traitement à base de nourriture médicamentée. On a séparé les poissons utilisés dans l'étude expérimentale de ceux du groupe témoin jusqu'à la fin du traitement, c'est-à-dire jusqu'à ce que la nourriture médicamentée soit vidangée des bassins. Les poissons ont reçu une ration quotidienne correspondant à 0,78 % de leur poids corporel (kg) administrée en deux doses, le matin et en fin d'après-midi. En sus de la nourriture médicamentée, un supplément de nourriture pour atteindre une ration de 1 % du poids corporel par jour a été administré aux poissons.
Une fois le régime médicamenteux terminé (jour 7), des poissons de chaque groupe ont été échantillonnés au hasard pour chacune des périodes d'échantillonnage prévues après le traitement. Après l'échantillonnage du jour 1, on a prélevé au hasard des échantillons supplémentaires de deux poissons les jours d'échantillonnage 3 et 5, et de trois poissons les jours 10, 15, 30 et 45 en vue d'estimer la distribution de BE dans la population étudiée.
Plan expérimental sur le terrain
On a sélectionné les sites d'élevage en cages parmi les sites commerciaux où l'on administre des traitements au BE, ou l'on prévoit le faire. Le ministère de l'Agriculture, de l'Aquaculture et des Pêches du Nouveau-Brunswick a participé à la sélection des sites et à l'échantillonnage.
Protocole d'échantillonnage
Les poissons échantillonnés ont été euthanasiés par l’administration d’une surdose d'anesthésiants, ils ont été pesés avant de les laisser se vider de leur sang dans de l'eau de mer glaciale pour reproduire les procédures de transformation de l'industrie salmonicole. Les poissons ont été rincés à l'eau salée, placés dans des sacs individuels et transportés sur la glace jusqu'au laboratoire. On a prélevé les deux filets du poisson avec la peau. Tous les échantillons ont été congelés à -10 °C jusqu'à l'analyse.
Résultats
Généralités
Les résultats de cette étude qui sont présentés ici portent sur la composante principale des essais en laboratoire de cette étude, réalisée dans le cadre du Programme coopératif de recherche et développement en aquaculture, qui portent sur l’analyse les résidus de BE dans le saumon.
Dose administrée
Après l'administration de la nourriture médicamentée en laboratoire, le comportement alimentaire a diminué, et les poissons ont cessé de s'alimenter au jour 2. Pour rendre les aliments plus appétissants, on les a alors enrobés de krill sec (2 % du poids). Bien que les vétérinaires ayant prescrit ces aliments ne rapportent aucun problème d'appétibilité (Dr Mark Moore, MVS, Upper Letang, N.-B., communication personnelle) dans le cadre de l'industrie aquacole du Canada atlantique, le comportement alimentaire s'est normalisé après l'ajout de krill aux aliments. Aucun problème semblable a été signalé sur le terrain dans les sites aquacoles, où la ration alimentaire quotidienne a pu être maintenue.
Les trois laboratoires utilisés pour déterminer le taux d'inclusion de BE dans les aliments médicamenteux ont obtenu trois résultats différents (tableau 1). Pour un taux d'inclusion souhaité de 10 mg / kg, on a obtenu des valeurs situées entre 6,6 mg / kg et 8,8 mg / kg (c'est-à-dire de 54 % à 88 % de la concentration visée). La dose nominale de BE dans les aliments mesurée par Cantest Ltd. était statistiquement légèrement plus faible que celle mesurée par les deux autres laboratoires (p = 0,0513).
Résidus d'BE
Des résidus ont été détectés dans la peau de 43,9 % des poissons-témoins (des concentrations de 2,04 à 4,00 ng / g). Bien que l'on ait rincé les réservoirs avant l'introduction des poissons-témoins, il est possible que ces poissons aient consommé les excréments des poissons traités, ce qui expliquerait les concentrations résiduelles de BE dans la peau. On n'a pas détecté de résidus dans les muscles des poissons-témoins.
Au jour 45, la prise de poids quotidienne était de 5,8 g par jour et tous les poissons avaient un poids considérablement plus élevé qu'au début de l'essai (p = 0,0001). On n'a décelé aucun effet du sexe et du degré de maturité sur la teneur de BE dans le tissu musculaire et dans la peau des poissons traités (p = 0,321). Tous les poissons semblaient en bonne santé et aucune anomalie ni difformité n'ont été observées.
La moyenne des concentrations de résidus de BE mesurées se situait entre 60,5 ng / g le premier jour après le traitement et 7,3 ng / g au jour 45 (figure 2). La moyenne des concentrations de résidus de BE mesurées était plus élevée dans les tissus cutanés où elle se situait entre 219,6 ng / g au jour 5 après le traitement et 9,6 ng / g le jour 45. La concentration de résidus de benzoate d'émamectine dans les poissons étudiés était 2,8 à 6 fois plus élevée dans la peau que dans le tissu musculaire (4,1 fois plus élevée en moyenne). Les raisons expliquant cette observation sont inconnues, mais cela explique les niveaux soutenus de résidus de BE dans la peau, qui constitue l'organe principal visé par le pou du poisson.
Les concentrations de BE n'ont jamais atteint les concentrations maximales de résidus autorisées par SC et l'ACIA de 100 et de 1 000 ng / g respectivement pour les tissus musculaires et les tissus cutanés. Les résidus de BE mesurés lors des essais sur le terrain confirment les résultats obtenus en laboratoire puisqu’après le traitement de 7 jours au SLICE®, les concentrations de résidus dans les tissus n'ont jamais excédé les niveaux imposés. Les concentrations de résidus dans les échantillons des essais sur le terrain variaient d'un poisson échantillonné à l'autre. L'élimination de BE dans les tissus musculaires est rapidement tombée à des niveaux négligeables 3 à 7 jours après le traitement.
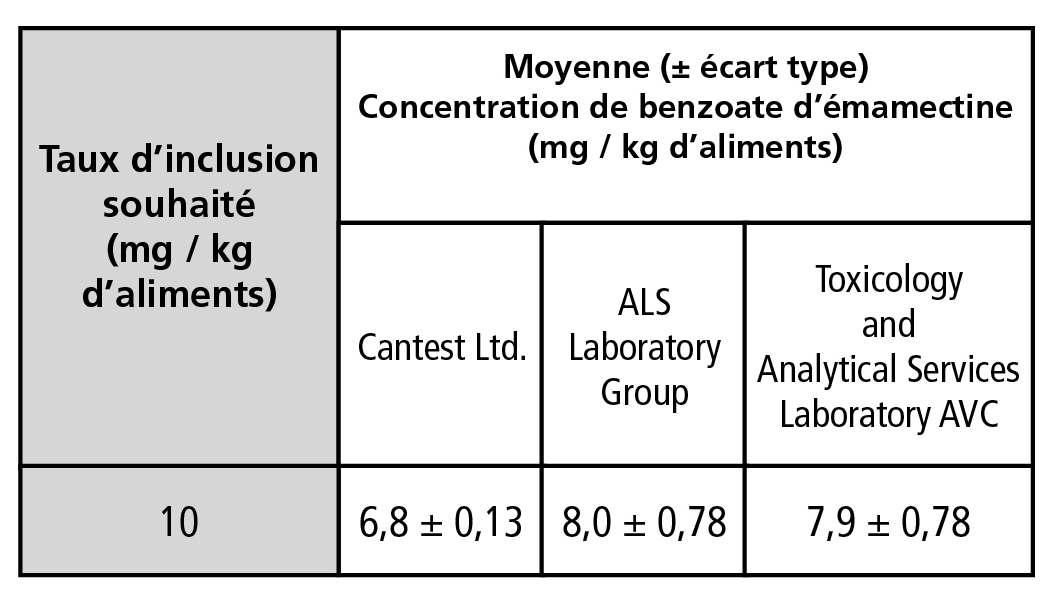
Tableau 1.
Concentrations moyennes de benzoate d'émamectine (mg / kg d'aliments) dans les échantillons de nourriture médicamentée mesurées par trois laboratoires analytiques indépendants (n = 5).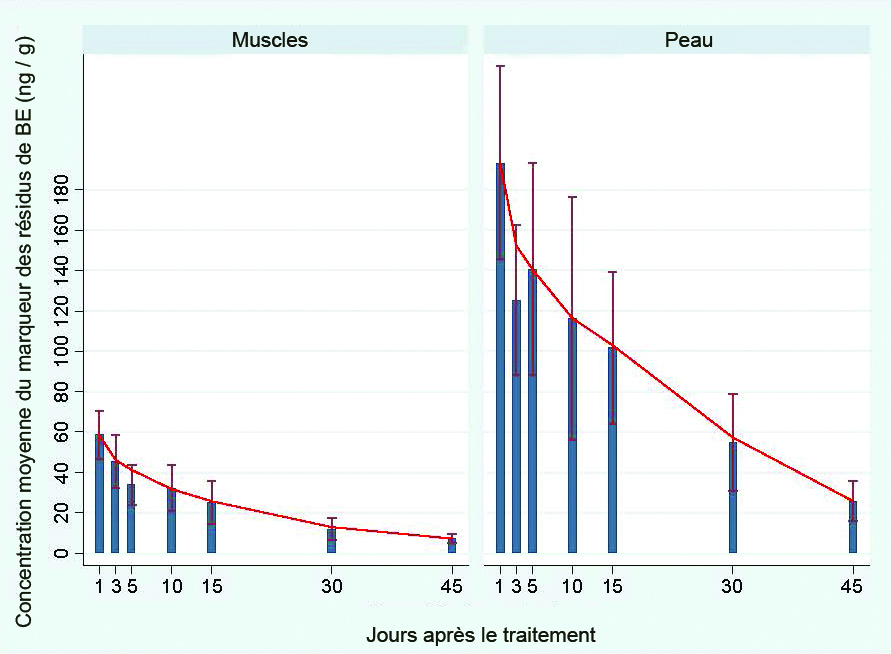
Figure 2.
Concentration moyenne (ng / g ± écart type) de SLICE® (BE) dans les tissus musculaires et cutanés du saumon de l’Atlantique auquel on a administré 50 ng / g de BE par kg de poids corporel pendant 7 jours consécutifs. Note : la ligne indique la meilleure estimation pour la teneur en résidu.Conclusion
Au moment de l'étude, la Direction des médicaments vétérinaires de Santé Canada et l'Agence canadienne d'inspection des aliments n'autorisaient qu'une concentration maximale de résidus dans les poissons destinés à la consommation humaine de 100 ng / g pour le tissu musculaire et de 1 000 ng / g pour la peau. Dans la présente étude, aucune concentration de résidus de BE avoisinant les doses recommandées de 50 μg de BE par kg dans le tissu musculaire ou dans la peau n’a été observée. Les résultats de l'étude ont joué un rôle fondamental pour l'approbation du SLICE® par la Direction des médicaments vétérinaires et pour la modification du délai d’attente à 0 jour. La valeur monétaire des résultats de cette étude ne peut pas être estimée avec exactitude. Cependant, puisqu’il facilite la lutte contre le pou du poisson et l'accès au marché du saumon, ce produit vaut des millions de dollars pour l'industrie.
Références
Whyte, S.K., Westcott, J.D., Byrne, P. et Hammell, K.L.. 2011. Comparison of the depletion of emamectin benzoate (SLICE®) residues from skeletal muscle and skin of Atlantic Salmon (Salmo salar), for multiple dietary dose regimens at 10°C. Aquaculture 315, 228-235.
Le projet du PCRDA (MG-06-04-004) est le fruit d'un effort de collaboration entre Pêches et Océans Canada (MPO) et l'Atlantic Canada Fish Farmers Association (ACFFA). Il est possible de communiquer avec le scientifique principal du projet, Dr Phil Byrne, à l'adresse suivante : Philip.Byrne@dfo-mpo.gc.ca.
Pour obtenir de plus amples renseignements sur le présent projet et d'autres projets du PCRDA, veuillez visiter le: Programme coopératif de recherche et développement en aquaculture (PCRDA)
Publié par :
Pêches et Océans Canada,
Direction générale des sciences de l'aquaculture, de la biotechnologie et santé des animaux aquatiques,
Ottawa (Ontario) K1A 0E6
© Sa Majesté la reine du chef du Canada, 2013.
ISSN 1919-6849 (Imprimé)
ISSN 1919-6857 (en ligne)
ISBN : 978-0-660-21535-8
MPO/2013-1914
No de catalogue : Fs48-2/21-2014F-PDF
La version anglaise et d'autres formats sont disponibles à l'adresse suivante : Aquaculture Collaborative Research and Development Program (ACRDP)
- Date de modification :