Les océans du Canada maintenant : Écosystèmes de l’Atlantique, 2018
![]()
Les océans du Canada maintenant : Écosystèmes de l’Atlantique, 2018 (non interactif) (PDF, 43,35 MB)
Table des matières
- Avant-propos
- Introduction
- L’environnement océanique
- La vie dans l’Atlantique
- Phytoplancton
- Zooplancton
- Liens cruciaux entre le climat et la productivité marine
- Battures intertidales
- Herbiers de zostère
- La zostère : une espèce d’importance écologique
- Gisements de varech
- Coraux et éponges
- Gisements de clypéastres
- Communautés de poissons et d’invertébrés
- C’est compliqué : les phoques et la morue franche
- Nouvelles espèces d’eau chaude
- Mammifères marins
- Tortues de mer
- Oiseaux de mer
- Espèces aquatiques envahissantes
- Tout est interrelié
Avant-propos
Les rapports Les océans du Canada maintenant sont des résumés annuels de l’état actuel des océans du Canada et des tendances qu’ils affichent. Ces rapports, qui sont publiés à l’intention des Canadiens, font partie de l’engagement du gouvernement du Canada d’informer ses citoyens sur l’état actuel et l’état futur potentiel des océans du Canada.
Le présent rapport, Les océans du Canada maintenant : Écosystèmes de l’Atlantique, présente l’état actuel des écosystèmes marins de l’Atlantique canadien et leurs tendances jusqu’à la fin de 2017. Il repose sur une synthèse scientifiqueNote de bas de page 1, qui a été présentée au cours d’une réunion scientifique en décembre 2017, qui consistait en des résumés de la documentation revue par des pairs et des données disponibles sur certains volets de l’océanographie physique et chimique, de l’océanographie biologique, des habitats, des communautés de poissons et d’invertébrés, des mammifères marins, des tortues de mer et des oiseaux de mer. Des chercheurs de Pêches et Océans Canada (MPO) et leurs collègues d’Environnement et Changement climatique Canada (ECCC) ont contribué à l’examen par des pairs et ont publié des données recueillies au cours des programmes de surveillance et de recherche pour le présent rapport. Ces renseignements seront mis à jour dans de prochains rapports, ce qui permettra d’avoir un portrait constant de l’état des écosystèmes marins de l’Atlantique canadien et des tendances qu’ils affichent.
Introduction
La compréhension de la santé du milieu marin revêt une importance cruciale pour une nation bordée d’océans comme le Canada. Les océans Atlantique, Arctique et Pacifique soutiennent tous les Canadiens. Chaque Canadien est profondément attaché à ces écosystèmes marins dynamiques. Nos océans soutiennent tous les jours des activités récréatives et touristiques, culturelles et spirituelles, ainsi que la santé des Canadiens. Ils représentent une importante source de nourriture et de ressources naturelles à travers le pays. À une échelle plus vaste, toute la vie sur notre planète dépend du rôle que jouent les océans dans la régulation du climat mondial, le cycle des éléments nutritifs et la biodiversité.
Les écosystèmes marins comprennent l’environnement physique et chimique, et un vaste éventail d’organismes vivants, depuis le plancton minuscule jusqu’aux baleines géantes. Ces écosystèmes sont variés, complexes et naturellement dynamiques. Mais les incidences supplémentaires des activités humaines et du changement climatique entraînent d’autres changements qui peuvent avoir de lourdes conséquences pour la santé des écosystèmes marins.
Le changement climatique est l’un des principaux moteurs des changements observés dans l’environnement de l’océan Atlantique. La hausse des températures atmosphériques entraîne notamment un réchauffement des températures de la surface de la mer, une diminution de la couverture de glace, la hausse du niveau de la mer et la modification des courants océaniques. L’absorption accrue du dioxyde de carbone par les eaux de surface de la mer entraîne l’acidification des océans. Il peut être difficile de comprendre les liens entre ces divers éléments. Cependant, ces connaissances sont plus importantes que jamais.
En tant que nation bordée par des océans, le Canada a la responsabilité d’étudier et de protéger ces écosystèmes marins. Des chercheurs du gouvernement surveillent régulièrement les océans et mènent des recherches pour suivre l’état de ces derniers ainsi que les tendances au fil du temps.
Dans le présent rapport, on examine les connaissances acquises par les chercheurs à propos de l’environnement de l’océan Atlantique. À partir de la température de surface de la mer allant jusqu’à l’abondance des populations de poissons, il résume globalement la santé et l’état de l’océan Atlantique du Canada.
Les trois zones océaniques de l’Atlantique canadien
L’océan Atlantique canadien est divisé en trois biorégions : les plateaux de Terre-Neuve et du Labrador, le plateau néo-écossais et le golfe du Saint-Laurent (figure 1). Chaque biorégion est délimitée en fonction de différences géographiques quant aux conditions et à la profondeur de l’océan et présente des caractéristiques qui lui sont propres. Cependant, les limites qui les séparent sont des zones de transition, et non des frontières abruptes.
L’océan Atlantique canadien est fortement influencé par des changements saisonniers dans les courants, la température de l’eau, la glace de mer et le ruissellement des eaux douces. Les changements saisonniers dans la glace de mer, notamment sur les plateaux de Terre-Neuve et du Labrador et dans le golfe du Saint-Laurent, ont une incidence sur l’apport d’eau douce et le moment des proliférations de phytoplancton. Le courant du Labrador amène de l’eau froide provenant de l’Arctique le long des plateaux de Terre-Neuve et du Labrador (figure 2). Il s’agit de la pénétration la plus méridionale des eaux de l’Arctique de l’hémisphère Nord. La partie méridionale du plateau néo-écossais est réchauffée par les eaux du Gulf Stream provenant du sud. Le mélange de ces deux courants d’eau crée une zone affichant une productivité élevée le long de la queue des Grands Bancs de Terre-Neuve qui soutiennent les écosystèmes régionaux. Le golfe du Saint-Laurent reçoit d’importants apports d’eau douce provenant du fleuve Saint-Laurent, lesquels se mélangent avec les eaux de l’Atlantique : les eaux du plateau du Labrador traversant le détroit de Belle Isle, et un mélange des eaux froides du courant du Labrador avec les eaux chaudes du Gulf Stream par le détroit de Cabot.

Figure 1 : Les trois biorégions de l’Atlantique canadien – L’emplacement des biorégions repose sur les conditions océaniques et la profondeur. Les sous-divisions de l’Organisation des pêches de l’Atlantique Nord-Ouest (OPANO) sont des limites utilisées pour la recherche et la gestion des diverses ressources marines. On y fait référence tout au long du rapport.
L’environnement océanique
Les changements dans l’environnement physique ont d’importantes répercussions sur les systèmes biologiques à différentes échelles. Par exemple, le réchauffement des températures causé par le changement climatique peut avoir des répercussions sur des organismes individuels, comme des changements dans les taux de croissance de certaines espèces ou des changements à plus vaste échelle, comme des modifications des réseaux trophiques.
Les océanographes mesurent les conditions océaniques au large de la côte Atlantique depuis des décennies. Cette mine de données est utilisée pour mieux comprendre les liens entre l’environnement et les écosystèmes, et pour évaluer les effets des activités humaines. Deux importants programmes du MPO permettent de recueillir des données sur les conditions océaniques, soit le Programme de monitorage de la zone Atlantique (PMZA) et le Programme de monitorage de la zone Atlantique au large du plateau continental (PMZAO). Ils permettent d’étudier les propriétés physiques, chimiques et biologiques sur les plateaux et les pentes continentaux qui se trouvent au large de la côte est du Canada.
Durant les relevés de surveillance et de recherche, des dispositifs d’échantillonnage connus sous le nom de rosettes sont déployés dans la colonne d’eau. Les capteurs dont ils sont équipés peuvent mesurer des variables physiques et chimiques comme la température, l’oxygène dissous et l’acidité. Les dispositifs comportent également des bouteilles pour le prélèvement d’échantillons d’eau à différentes profondeurs. On peut analyser ces échantillons à bord de navires ou dans un laboratoire en milieu terrestre. Les données recueillies, combinées aux données d’autres sources comme l’imagerie par satellite, nous offrent un portrait plus complet de la santé de l’océan. Les conditions environnementales sont habituellement consignées de manière à montrer comment elles s’écartent des moyennes à long terme. Ces différences sont appelées des anomalies. En ce qui concerne les températures mesurées par la télédétection, on calcule généralement ces anomalies par rapport à la température moyenne mesurée sur des périodes s’échelonnant entre 1985 et 2010, et 1981 et 2010 pour d’autres paramètres océanographiques.
Température
Les eaux de l’Atlantique Nord sont tempérées, et deviennent froides ou chaudes selon la saison. Les températures des eaux superficielles varient avec la température atmosphérique. Les eaux plus profondes ne présentent pas beaucoup de changement saisonnier, mais subissent plutôt l’incidence des courants. Le mélange des eaux plus froides et plus douces amenées par le courant du Labrador avec des eaux plus chaudes et plus salées amenées par le Gulf Stream représente une interaction importante.
La hausse des températures atmosphériques due au changement climatique et la modification des courants se traduisent par des températures plus chaudes à la surface de la mer et en profondeur (figure 3, figure 4). La température est un important facteur environnemental. Elle influe sur tous les processus, depuis les processus physiques (comme la formation de glace de mer et le mélange dans la colonne d’eau) jusqu’à la condition et au comportement des espèces.
Les chercheurs mesurent les températures de l’eau dans toute la colonne d’eau en utilisant des capteurs automatisés et prennent des mesures directes par l’entremise de relevés de recherche. Ils interprètent également l’information recueillie par satellite. La température de la surface de la mer mesurée par télédétection est consignée pour les périodes de l’année où la mer est libre de glace. Ces périodes varient selon les années et les régions (du nord au sud).
État et tendances
- La température de la surface de la mer durant les mois où la mer est libre de glace est liée à la température atmosphérique. L’élévation de la température atmosphérique que l’on constate depuis les années 1870 est d’environ 1 ℃ par siècle. En conséquence, les eaux superficielles de l’Atlantique canadien se réchauffent.
- Pour la région, deux des cinq années les plus chaudes enregistrées depuis que l’on recueille des observations par satellite sont les années 2012 (la plus chaude) et 2014 (la quatrième).
- En 2012, le plateau néo-écossais, le banc de Saint-Pierre et le Grand Banc ont affiché les températures de la surface de la mer les plus chaudes depuis 1985, lorsque les données d’observation par satellite sont devenues disponibles pour la première fois. L’estuaire du Saint-Laurent a affiché ses températures de la surface de la mer les plus chaudes en 2016.
- L’influence du Gulf Stream augmente par rapport à celle du courant du Labrador. Il en résulte des températures élevées records des eaux profondes du plateau néo-écossais et des chenaux profonds du golfe du Saint-Laurent. On a observé un pic record sur 100 ans dans le nord du golfe du Saint-Laurent pour la période s’échelonnant entre 2012 et 2016.
- Entre 2012 et 2016, les plateaux de Terre-Neuve et du Labrador ont affiché des températures au fond globalement supérieures à la moyenne, avec certaines températures près de la moyenne enregistrées durant la deuxième moitié de la période. Un pic record sur 33 ans a également été observé au large du sud de Terre-Neuve.

Figure 3 : Indice de la température de la surface de la mer pour les biorégions de l’Atlantique mesuré durant les périodes de l’année où la mer était libre de glace. Ces valeurs sont comparées à la moyenne pour la période s’échelonnant entre 1985 et 2010. La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO). Les tendances supérieures à la moyenne représentent des conditions chaudes.

Figure 4 : Indice des températures au fond de l’océan pour les biorégions de l’Atlantique par rapport à la moyenne à long terme (1981-2010). La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO). Les tendances supérieures à la moyenne représentent des conditions chaudes. Des changements dans les courants ont entraîné des pics records depuis 2012.
Glace de mer et couche intermédiaire froide
Les changements saisonniers dans la glace de mer et les couches de la colonne d’eau jouent des rôles importants dans la manière dont se comportent les écosystèmes de l’Atlantique Nord. La couche intermédiaire froide (CIF) est une importante caractéristique de cette région. La CIF se forme dans certains secteurs lorsque la couche de mélange froide hivernale est piégée par le réchauffement printanier en surface, de pair avec l’apport d’eau douce provenant de la fonte de la glace de mer et du ruissellement à partir des terres, formant une couche moins dense au sommet de la colonne d’eau [voir Stratification et couche intermédiaire froide]. Dans certains secteurs, la stratification peut persister durant la plus grande partie de l’année. Comme la couverture de glace et la CIF se forment toutes deux en hiver, elles sont souvent reliées l’une à l’autre ainsi qu’avec la température atmosphérique en hiver. Les données sont donc combinées en un seul indice (figure 5). La CIF a une incidence sur le mélange dans la colonne d’eau. Cela a des conséquences sur la manière dont se répartissent les éléments nutritifs, qui a un effet sur la productivité des écosystèmes.
Les changements saisonniers dans la glace de mer, notamment sur les plateaux de Terre-Neuve et du Labrador et dans le golfe du Saint-Laurent, influent sur les apports d’eau douce et les moments de prolifération du phytoplancton (voir la section sur le phytoplancton). La glace de mer offre également des habitats pour des organismes qui vivent sur et sous la glace.
La couverture de glace fait l’objet d’une surveillance par le Service canadien des glaces (ECCC), lequel fait des relevés aériens et utilise l’imagerie par satellite pour obtenir des données sur des facteurs importants comme l’étendue maximale de la glace de mer dans les zones méridionales et le moment où elle est observée. On estime également la couverture, l’épaisseur et le volume de la glace.
État et tendances
- Le changement climatique entraîne une diminution de la couverture de glace dans les écosystèmes marins de l’Atlantique. Depuis la fin des années 1800, les hivers plus chauds enregistrés ont mené à de plus longues périodes où la mer est libre de glace et à une diminution du volume de la glace.
- Durant la dernière décennie, les volumes de glace sur les plateaux de Terre-Neuve et du Labrador, dans le golfe du Saint-Laurent et sur le plateau néo-écossais ont été inférieurs à la moyenne durant la plupart des années. Les volumes de glace ont atteint un creux record dans le golfe du Saint-Laurent en 2010 et sur les plateaux de Terre-Neuve et du Labrador en 2011.
- Sur les plateaux de Terre-Neuve et du Labrador, pour la période s’échelonnant entre 2010 et 2016, on a recensé trois années parmi les sept durant lesquels les volumes de la glace moyens étaient parmi les plus faibles jamais enregistrés. Dans le golfe du Saint-Laurent, cinq années figuraient parmi les sept où les volumes de la glace de mer moyens étaient parmi les plus faibles jamais enregistrés.
- Des hivers plus chauds entraînent une CIF plus ténue. En 2012, on a enregistré des creux records des volumes de la CIF dans le golfe du Saint-Laurent et sur le plateau néo-écossais, ce qui représente des conditions chaudes records.

Figure 5 : Indice de la couche intermédiaire froide (CIF) et volume de la glace de mer dans les biorégions de l’Atlantique par rapport à la moyenne à long terme (1981-2010). La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO). Des tendances supérieures à la moyenne sont observées lorsque des conditions de réchauffement entraînent une diminution de la glace de mer et une CIF plus ténue.
Stratification et couche intermédiaire froide
L’océan se stratifie, car les couches d’eau affichant des densités différentes rendent plus difficile le mélange dans la colonne d’eau (figure 6). Durant l’automne et l’hiver, le refroidissement et le vent causent des mélanges et une homogénéisation des couches supérieures de l’océan. Au printemps et en été, les eaux superficielles deviennent moins denses en raison du réchauffement et de l’apport d’eau douce accru provenant de la fonte des glaces et du ruissellement sur les terres. Cette eau moins dense ne se mélange pas facilement aux eaux profondes plus denses et plus froides, ce qui mène à la stratification. Une couche intermédiaire froide (CIF) se forme tandis que les eaux froides durant l’hiver sont piégées en dessous de cette couche superficielle moins dense. Dans certaines zones peu profondes, la CIF peut s’étendre jusqu’au fond, mais, dans d’autres, il demeure une troisième couche profonde plus dense. La température de l’eau utilisée pour définir la CIF diffère selon les biorégions. Sur les plateaux de Terre-Neuve et du Labrador, cette température est inférieure à 0 ℃, dans le golfe du Saint-Laurent, elle est inférieure à 1 ℃ et sur le plateau néo-écossais, elle est inférieure à 4 ℃.

Figure 6 : La stratification de l’océan est influencée par la température, l’apport d’eau douce provenant des terres et de la fonte de la glace de mer, ainsi que par l’énergie découlant du mélange déclenché par le vent et les courants, qui changent selon les saisons.
Oxygène

Figure 7 : Mesures de l’oxygène dissous moyen, du pH (acidité) et de la température dans la partie basse de l’estuaire du Saint-Laurent, à une profondeur d’environ 300 mètres. Lorsque les valeurs de l’oxygène dissous se situent en deçà d’un niveau de saturation de 30 %, les conditions sont considérées comme étant extrêmement hypoxiques.
La quantité d’oxygène dissous dans l’eau de mer est importante pour la santé des organismes marins. Dans les eaux profondes, le mélange à partir des eaux superficielles peut remplacer l’oxygène. Lorsqu’il y a peu de mélange, l’oxygène dissous peut être appauvri par la respiration des organismes et par la décomposition de la matière organique. Lorsque les niveaux d’oxygène sont trop faibles, on parle d’hypoxie. Lorsque les niveaux d’oxygène chutent en deçà de 30 % du seuil de saturation, on considère que l’hypoxie est sévère. Cela peut avoir de graves effets sur les écosystèmes. Les changements climatiques peuvent contribuer à l’hypoxie. Il en va de même de l’apport de matières organiques provenant des efflorescences algales causées par de hauts niveaux d’éléments nutritifs. Il s’agit d’un problème dans le golfe du Saint-Laurent (figure 7).
L’hypoxie peut nuire de façon considérable à la vie et aux écosystèmes marins. Elle peut ralentir la croissance et réduire le succès reproducteur des espèces océaniques. Elle peut également avoir une incidence sur la manière dont se répartissent les espèces, car la plupart d’entre elles s’éloignent des zones avant que l’hypoxie ne les tue. Dans des conditions d’hypoxie sévère, les espèces qui ne peuvent pas s’éloigner assez rapidement des zones touchées peuvent présenter de hauts taux de mortalité.
On mesure régulièrement l’oxygène dissous dans l’ensemble de la colonne d’eau dans le cadre des relevés océanographiques qui sont effectués dans la région.
État et tendances
- L’incidence plus importante de l’eau amenée par le Gulf Stream contribue à la présence de conditions hypoxiques dans l’estuaire profond du Saint-Laurent. Tandis que les eaux profondes de l’estuaire du Saint-Laurent étaient hypoxiques de façon épisodique durant le début des années 1960, elles le sont de façon constante depuis 1984.
- L’oxygène dissous dans le golfe du Saint-Laurent a diminué pour s’établir à sa moyenne annuelle la plus faible en 2016. Cela correspond à un niveau de saturation de 18 %.
Acidification
L’acidité de l’océan augmente puisque les eaux absorbent des quantités de dioxyde de carbone atmosphérique découlant des activités humaines toujours plus importantes. Le dioxyde de carbone se dissout dans l’eau superficielle de l’océan et forme de l’acide carbonique. Une augmentation de l’acidité rend les eaux plus corrosives pour le carbonate de calcium, qui est le principal composant des squelettes et des coquilles de bon nombre d’organismes, dont le plancton, les mollusques, les crustacés et les coraux. L’augmentation de l’acidité peut également causer un stress physiologique accru chez ces organismes. Ces changements peuvent avoir des conséquences sur les réseaux trophiques et les écosystèmes dans leur ensemble.
On mesure l’acidité de façon constante depuis les années 1990. Des mesures intermittentes sont prises depuis les années 1930. On mesure l’acidité sur l’échelle du pH [voir pH]. Des pH plus faibles indiquent que les conditions sont plus acides, et des pH plus élevés, que les conditions sont moins acides (figure 7).
État et tendances
- De façon générale, l’acidité a augmenté à un rythme plus rapide dans les eaux de l’Atlantique canadien que dans d’autres régions du monde.
- L’acidité des eaux qui sont adjacentes au plateau de Terre-Neuve (mer du Labrador) a augmenté de façon constante depuis que des mesures cohérentes ont été prises, soit à partir de 1993. Cette hausse en acidité est mesurée comme une diminution du pH à un rythme d’environ 0,02 unité de pH par décennie.
- L’acidité des eaux au large de le plateau néo-écossais et dans le golfe du Saint-Laurent augmente également. Sur le plateau néo-écossais, le pH a diminué à un rythme d’environ 0,03 unités de pH par décennie. Le golfe du Saint-Laurent, pour sa part, a connu une diminution du pH d’environ 0,04 unité de pH par décennie depuis 1934.
Ruissellement et stratification

Figure 8 : Stratification de la colonne d’eau mesurée en tant que différence entre la densité de l’eau superficielle et la densité de l’eau à 50 mètres de profondeur. En ce qui concerne l’estuaire du Saint-Laurent, l’estimation repose sur le ruissellement d’eau douce. Une grande différence en matière de densité, comme c’est le cas dans l’estuaire du Saint-Laurent, signifie que la stratification est plus prononcée et que le mélange est potentiellement inhibé. Sur le plateau néo-écossais et sur les plateaux de Terre-Neuve et du Labrador, la différence est moins importante. On constate une stratification moins prononcée dans ces secteurs.
La circulation et le mélange des eaux de l’océan peuvent subir les conséquences du ruissellement, notamment dans les eaux qui reçoivent de grandes quantités d’eaux de ruissellement, comme l’estuaire du Saint-Laurent. La formation de couches (stratification) peut se produire dans la colonne d’eau parce que les eaux qui affichent des densités différentes ne se mélangent pas très facilement [voir Stratification et couche intermédiaire froide]. Le ruissellement des eaux douces à partir des terres peut accroître la stratification, car les eaux plus douces sont moins denses que les eaux plus salées. Avec l’action conjuguée des marées et du vent, le ruissellement exerce un effet moteur sur la circulation dans l’estuaire du Saint-Laurent et, dans une moindre mesure, dans l’ensemble du golfe du Saint-Laurent.
La stratification de l’océan peut affecter la manière dont les éléments nutritifs se mélangent dans les eaux superficielles. Un changement dans le mélange des éléments nutritifs influe sur la croissance et la prolifération du phytoplancton, ce qui a des répercussions sur la productivité de l’écosystème.
On mesure le degré de stratification dans la colonne d’eau en observant la différence dans les densités entre les eaux superficielles et les eaux qui se trouvent à une profondeur de 50 mètres. Les tendances à long terme sont indiquées pour trois emplacements : la station 27 (un site se trouvant au large de St. John’s, à Terre-Neuve-et-Labrador), la station de Rimouski, dans l’estuaire du Saint-Laurent, et le plateau néo-écossais. D’une année à l’autre, la stratification à la station de Rimouski a été fortement reliée au ruissellement moyen saisonnier dans le fleuve Saint-Laurent (figure 8).
Status and trends
- Le ruissellement de l’eau douce dans l’estuaire du Saint-Laurent a diminué entre le début des années 1970 et 2001. Cet état de fait a été suivi d’une tendance à la hausse entre 2001 et 2011, et à une relative stabilité jusqu’en 2016. Dans l’estuaire du Saint-Laurent, la stratification est liée au ruissellement saisonnier d’eau douce et a présenté un profil semblable.
- À la station 27, la stratification a augmenté, passant de valeurs inférieures à la moyenne au milieu des années 1960 à un pic record en 1995. Depuis lors, cette situation a été suivie d’une tendance principalement à la baisse.
- Depuis 1948, on a observé une augmentation de la stratification moyenne sur le plateau néo-écossais. Ce changement est principalement dû à une diminution de la densité des eaux superficielles (76 % du changement total de la densité). Cette diminution est causée à parts égales par le réchauffement et par l’apport d’eau douce dans les eaux superficielles.
Niveau de la mer

Figure 9 : Différence du niveau de la mer entre certains emplacements des biorégions de l’Atlantique à partir de 1890 jusqu’à 2011. Les valeurs sont par rapport à la moyenne pour la période s’échelonnant entre 1981 et 2010 dans chaque zone (voir la figure 1 pour prendre connaissance des emplacements). La fonte des glaces, de pair avec le réchauffement de l’océan, cause une élévation du niveau de la mer dans plusieurs zones situées le long de la côte atlantique à un rythme de 2 à 4 millimètres par année, tandis que le niveau de la mer baisse dans d’autres zones.
Tandis que les océans du monde se réchauffent et que les glaciers fondent en raison de la hausse des températures mondiales, le volume de l’eau de mer s’élève. Dans certains secteurs, ce phénomène est contre-balancé dans une certaine mesure puisque la terre continue de s’élever depuis la fin du dernier âge glaciaire, après l’enlèvement du poids de la glace. Cela signifie que certains secteurs connaîtront une élévation du niveau de la mer, et d’autres, une diminution (figure 9).
La hausse du niveau de la mer peut se traduire par une dégradation des habitats ou leur perte dans les zones côtières. Elle rend également les zones côtières plus vulnérables aux ondes de tempête. Cela peut avoir une incidence sur la répartition d’espèces importantes pour la formation d’habitats, comme la zostère et le varech.
On mesure les changements du niveau de la mer en utilisant des marégraphes et des satellites d’observation. Pour certains secteurs, des données sont disponibles depuis la fin des années 1800. Pour d’autres, la collecte des données a débuté au milieu des années 1900. Les tendances sont consignées par rapport aux mesures du niveau de la mer moyen pour la période s’échelonnant entre 1981 et 2010 dans chaque zone.
État et tendances
- Au sud, le niveau de la mer s’élève de 2 à 4 millimètres par année (par exemple, à Halifax, Saint-Jean, Charlottetown et St. John’s).
- Au nord, le niveau de la mer diminue de 2 millimètres par année (par exemple, à Nain).
- Le long de la côte nord du golfe du Saint-Laurent, le niveau de la mer varie. Il diminue dans le port de Harrington et s’élève à Sept-Îles. En ce qui concerne le sud de l’estuaire du Saint-Laurent, on dispose à l’heure actuelle de très peu d’éléments probants indiquant un changement du niveau de la mer.
Éléments nutritifs
Comme les plantes sur terre, le phytoplancton a besoin de lumière et d’éléments nutritifs pour croître. Parmi les éléments nutritifs les plus importants figurent l’azote (nitrates, nitrites et ammonium), le phosphore (phosphate) et la silice (silicate). L’azote est habituellement l’élément nutritif limitant la croissance du phytoplancton dans l’océan. Cela signifie qu’il est habituellement présent en plus faibles concentrations dans les eaux superficielles que d’autres éléments nutritifs. En conséquence, le cycle de l’azote au sein de la colonne d’eau est très important.
L’ampleur des proliférations printanières du phytoplancton dépend en partie de la quantité d’éléments nutritifs qui sont mélangés dans les eaux superficielles durant l’hiver. À l’automne, on peut observer une prolifération secondaire, qui est moins intense que celle qui se produit au printemps. Cela se produit lorsque les éléments nutritifs sont mélangés à partir des eaux profondes et vers les eaux superficielles qui ont connu un épuisement durant l’été. Comme le phytoplancton forme la base de nombreux réseaux trophiques marins, l’ampleur de la prolifération printanière est liée à la productivité globale de ces écosystèmes.
On mesure de façon régulière les éléments nutritifs dans l’ensemble de la colonne d’eau dans le cadre de relevés océanographiques menés dans la région de l’Atlantique. Les teneurs en azote sont consignées en tant qu’« inventaire des nitrates dans les eaux profondes » (figure 10). Cela représente les concentrations de nitrates dans les eaux plus profondes, lesquelles, à certains moments, peuvent se mélanger dans la colonne d’eau et devenir disponibles pour le phytoplancton.
État et tendances
- Les changements dans les concentrations de nitrates ne sont pas uniformes dans toutes les régions de l’Atlantique. Au cours des cinq dernières années, on a souvent observé des conditions bien en deçà de la moyenne à long terme dans bon nombre de régions de l’Atlantique Nord-Ouest.
- Les déclins les plus marqués, qui ont perduré jusqu’à 2014-2015, ont été observés sur le plateau de Terre-Neuve.
- Dans le golfe du Saint-Laurent et sur le plateau néo-écossais, les changements ont été plus modestes au fil du temps. Cependant, plus récemment, les niveaux des éléments nutritifs dans le golfe et sur le plateau néo-écossais se sont situés près de la moyenne et sous la moyenne, respectivement.
- Les inventaires des nitrates dans les eaux profondes sont hautement variables. Cependant, ils se sont situés en très grande partie à des niveaux moyens entre 2012 et 2016, après avoir affiché une tendance générale à la baisse entre 1999 et 2010.

Figure 10 : Indice des concentrations de nitrates mesurées dans des eaux profondes, entre 50 et 150 mètres. Ces valeurs sont comparées à la moyenne à long terme (1999-2010). La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO). Les tendances supérieures à la moyenne indiquent des concentrations plus élevées. Les niveaux des nitrates ont une incidence sur la prolifération printanière, qui est liée à la productivité d’autres espèces.
La vie dans l’Atlantique
Les eaux de l’Atlantique canadien représentent un environnement marin parmi les plus productifs au monde. Les communautés marines comprennent divers organismes, allant du phytoplancton microscopique, qui forme la base des réseaux trophiques marins, aux espèces de poissons et d’invertébrés, y compris des espèces commerciales importantes (p. ex. morue franche, crabe des neiges, homard d’Amérique) et à certains des mammifères les plus imposants que l’on puisse trouver sur terre, comme le rorqual bleu. Ces organismes vivent dans une grande diversité d’habitats. Dans les zones côtières, des habitats structurés comme les herbiers de zostère et les forêts de varech offrent des ressources alimentaires importantes pour d’autres organismes, un abri contre les prédateurs et des zones de croissance pour les juvéniles. Les coraux et les éponges d’eau froide dans les eaux profondes du large offrent des habitats plus complexes sur le plancher océanique, dont dépendent de nombreuses espèces pour s’abriter et se nourrir. L’Atlantique Nord-Ouest est également une aire d’alimentation importante pour beaucoup d’espèces migratrices, dont les tortues, les baleines et les oiseaux de mer.
Des observations scientifiques ont montré que ces écosystèmes connaissent des changements physiques et biologiques selon différents rythmes et à différentes échelles à travers la région de l’Atlantique. La répartition des espèces change, et les communautés changent. Toutes les espèces que l’on trouve dans cet écosystème marin ont connu des changements, depuis le phytoplancton et d’autres plantes marines jusqu’aux communautés d’invertébrés et de poissons, aux mammifères marins et aux oiseaux de mer. Des changements se produisent également dans les habitats soumis à des agents de stress. Cela entraîne des effets négatifs supplémentaires sur les espèces. Le changement climatique représente l’un des principaux moteurs de ces changements. Les activités humaines qui ont des répercussions comprennent la pêche, l’aménagement du littoral et l’exploitation des ressources.
Phytoplancton

Figure 11 : Indice des concentrations de chlorophylle a par rapport à la moyenne à long terme (1999-2010). On utilise ces valeurs pour indiquer la biomasse du phytoplancton. La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO). Les valeurs supérieures à la moyenne représentent des concentrations plus élevées. Dans la plus grande partie de la région, les biomasses du phytoplancton se sont situées bien en deçà de la moyenne depuis 2015.
Le phytoplancton est composé de plantes microscopiques qui produisent de l’oxygène et de la matière organique à partir de la lumière du soleil, du dioxyde de carbone et d’éléments nutritifs inorganiques, tout comme les plantes sur terre. L’abondance du phytoplancton augmente (proliférations) au printemps et, dans une moindre mesure, à l’automne. Les proliférations peuvent se produire lorsque la colonne d’eau est stable, de sorte que le phytoplancton peut demeurer près de la surface, où le rayonnement lumineux est important et où des éléments nutritifs sont disponibles.
Le phytoplancton soutient de nombreux réseaux trophiques marins en tant que source de nourriture principale pour le zooplancton, lequel, à son tour, est une source de nourriture pour bon nombre de poissons et de mammifères marins. L’abondance du phytoplancton est un indicateur de la productivité d’un système. Les changements dans le moment des proliférations printanières peuvent avoir des conséquences pour beaucoup d’autres organismes de l’écosystème.
Grâce à l’échantillonnage direct et à l’imagerie par satellite, les chercheurs mesurent la « chlorophylle a » à la surface de l’océan. La chlorophylle a est le principal pigment utilisé durant la photosynthèse. On utilise ces mesures pour représenter la biomasse et la productivité du phytoplancton dans l’océan. Plus on détecte de chlorophylle a, plus on présume qu’il y a de cellules de phytoplancton dans l’eau (figure 11). On évalue l’ampleur, le moment du pic et la durée des efflorescences en examinant les changements des concentrations de chlorophylle a (figure 12a, figure 12b, figure 12c). Ces mesures indiquent comment la totalité du système change d’une année à l’autre. [voir Liens cruciaux entre le climat et la productivité marine].
État et tendances
- La diminution des teneurs en éléments nutritifs et en chlorophylle peut indiquer que les écosystèmes de l’Atlantique présentent un plus faible potentiel de production que durant la dernière décennie.
- La tendance générale est à un déclin graduel de l’abondance globale du phytoplancton dans l’Atlantique. Depuis 2015, la plus grande partie de la région a affiché des niveaux de phytoplancton bien inférieurs à la moyenne.
- De façon générale, les profils de variation de l’abondance du phytoplancton reflètent les profils observés pour les éléments nutritifs. Cependant, ils accusent un retard de près d’une année par rapport à la variabilité des éléments nutritifs.
- Les profils de variation des caractéristiques des proliférations printanières de phytoplancton sont relativement uniformes à travers le nord-ouest de l’Atlantique.
- L’ampleur de la prolifération printanière a augmenté entre 1999 et 2011, année où elle a atteint son pic le plus élevé. Elle a ensuite décliné pour s’établir à des valeurs moyennes en 2016. La mesure dans laquelle l’amplitude de la prolifération printanière a varié a suivi un profil semblable.
- Le jour de l’année durant lequel la prolifération printanière débute a varié d’une année à l’autre. Le changement était, soit généralement plus précoce ou plus tardif par rapport à la moyenne sur des périodes de trois à cinq ans.
- Les conditions observées durant la période allant de 2010 à 2012 étaient très chaudes, et les proliférations printanières du phytoplancton étaient précoces. Cependant, le refroidissement graduel depuis lors semble avoir entraîné un retard général dans le début de la prolifération à partir de 2013-2016.
- La durée de la prolifération printanière varie considérablement d’une région à l’autre de l’Atlantique Nord-Ouest. Cependant, on a observé un déclin général de la durée globale de l’efflorescence entre 1999 et 2011, après quoi les conditions sont revenues près de la moyenne à partir de 2012-2015, puis ont affiché une durée record en 2016.

Figure 12 : Observations de la prolifération printanière du phytoplancton, notamment des indices démontrant a) l’ampleur, b) moments des pics et c) la durée de la prolifération. La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO).
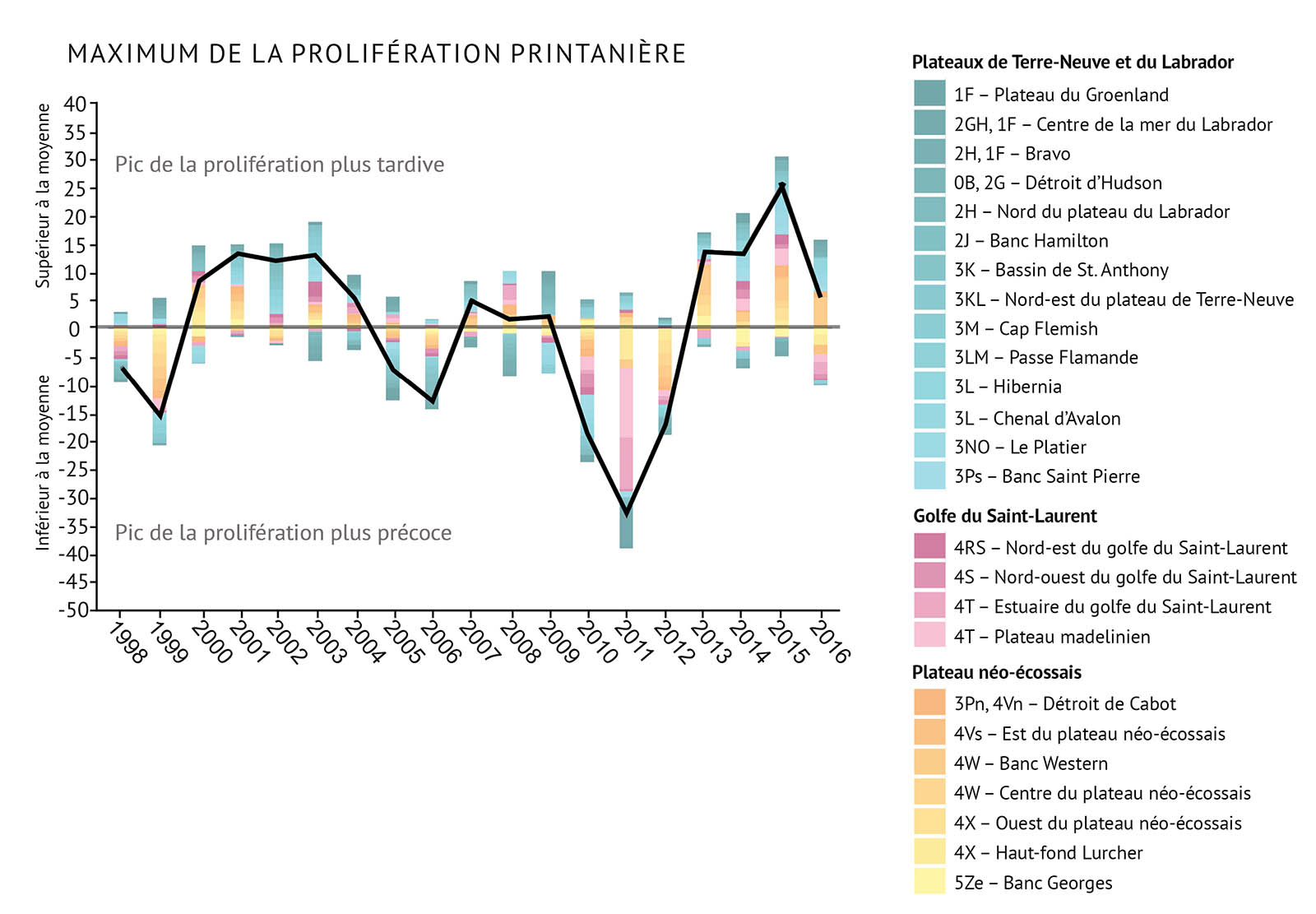
Figure 12 : Observations de la prolifération printanière du phytoplancton, notamment des indices démontrant a) l’ampleur, b) moments des pics et c) la durée de la prolifération. La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO).

Figure 12 : Observations de la prolifération printanière du phytoplancton, notamment des indices démontrant a) l’ampleur, b) moments des pics et c) la durée de la prolifération. La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO).
Zooplancton
Le zooplancton est constitué de petits animaux qui dérivent dans la colonne d’eau, se nourrissant de phytoplancton, de bactéries et de champignons. Leur taille varie de 0,2 à 20 millimètres. La structure de la communauté de zooplancton est fortement influencée par la profondeur et la température de l’eau, ainsi que par la saison. Les communautés présentent des différences considérables parmi les trois biorégions de l’Atlantique. Les copépodes sont les espèces de zooplancton les plus abondantes dans l’ouest de l’Atlantique Nord. L’une des espèces de plus grande taille, la plus répandue et la plus abondante et riche en énergie est le copépode Calanus finmarchicus. Des copépodes de plus petite taille, connus sous le nom de Pseudocalanus spp., sont moins riches en énergie, mais sont étudiées en tant qu’espèce représentant toutes les espèces de plus petite taille de la communauté.
Le zooplancton est un lien essentiel entre le phytoplancton et les animaux marins de plus grande taille. Comme C. finmarchicus est à la fois abondant et nutritif, les changements dans son abondance ont des conséquences importantes pour les animaux dont il est la principale source de nourriture.
Durant les relevés de recherche, le zooplancton est recueilli par des traits de filet. Les traits aident à établir l’abondance et les types d’espèces de zooplancton. L’abondance est consignée pour le zooplancton total, C. finmarchicus, Pseudocalanus spp. et les espèces de non-copépodes. On a constaté que la surveillance à ces quatre niveaux permettait de fournir une bonne indication de la santé des communautés de zooplancton dans les biorégions de l’Atlantique (figure 13a, figure 13b, figure 13c, figure 13d).
État et tendances
- Les changements dans les communautés de zooplancton indiquent qu’il existe des changements importants à la base de nombreux réseaux trophiques marins. Cela peut avoir des conséquences pour les niveaux supérieurs de ces réseaux trophiques.
- On a observé un changement dans la structure de la communauté de zooplancton. Les grands copépodes riches en énergie C. finmarchicus affichent une plus faible abondance. On observe une abondance plus élevée de petits copépodes d’eau chaude et d’espèces de non-copépodes.
- C. finmarchicus a décliné depuis 2009, le déclin le plus marqué étant observé sur le plateau néo-écossais.
- Les copépodes de plus petite taille, Pseudocalanus spp., ont vu leur abondance augmenter durant la dernière décennie, notamment dans le golfe du Saint-Laurent et sur le plateau de Terre-Neuve. Ces organismes ont atteint des niveaux records dans la plus grande partie de la zone atlantique.
- Depuis 2014, l’abondance des copépodes totaux et l’abondance des non-copépodes ont également augmenté à des niveaux supérieurs à la moyenne. Les valeurs les plus élevées ont été enregistrées dans le golfe du Saint-Laurent et sur les plateaux de Terre-Neuve et du Labrador. Le zooplancton non-copépode présente une abondance élevée record dans les trois biorégions depuis 2014.
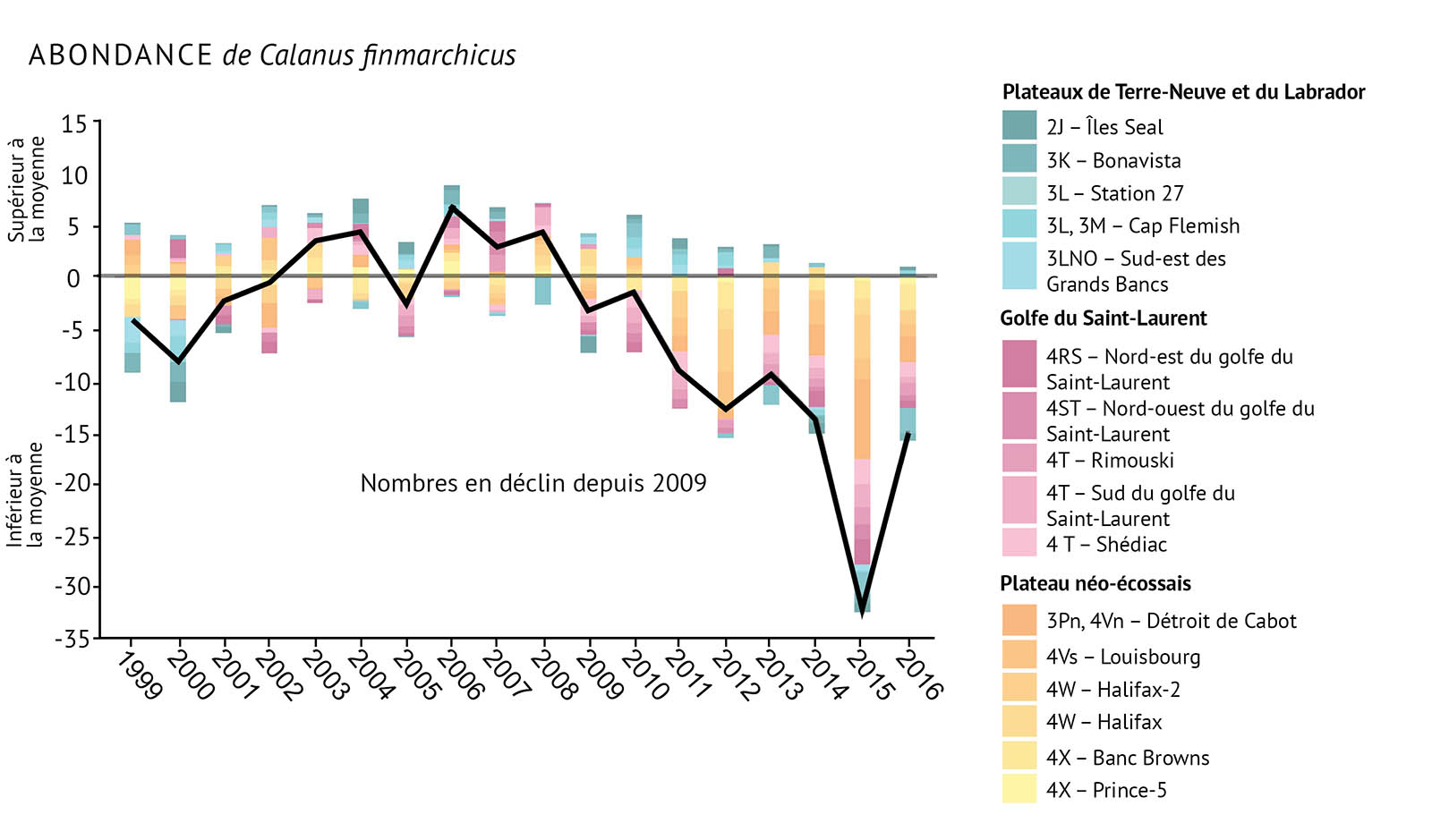
Figure 13 : Observations de l’abondance du zooplancton, y compris des indices pour a) Calanus finmarchicus, b) Pseudocalanus spp., c) le total des espèces de copépodes, et d) les espèces non-copépodes. La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO).

Figure 13 : Observations de l’abondance du zooplancton, y compris des indices pour a) Calanus finmarchicus, b) Pseudocalanus spp., c) le total des espèces de copépodes, et d) les espèces non-copépodes. La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO).

Figure 13 : Observations de l’abondance du zooplancton, y compris des indices pour a) Calanus finmarchicus, b) Pseudocalanus spp., c) le total des espèces de copépodes, et d) les espèces non-copépodes. La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO).
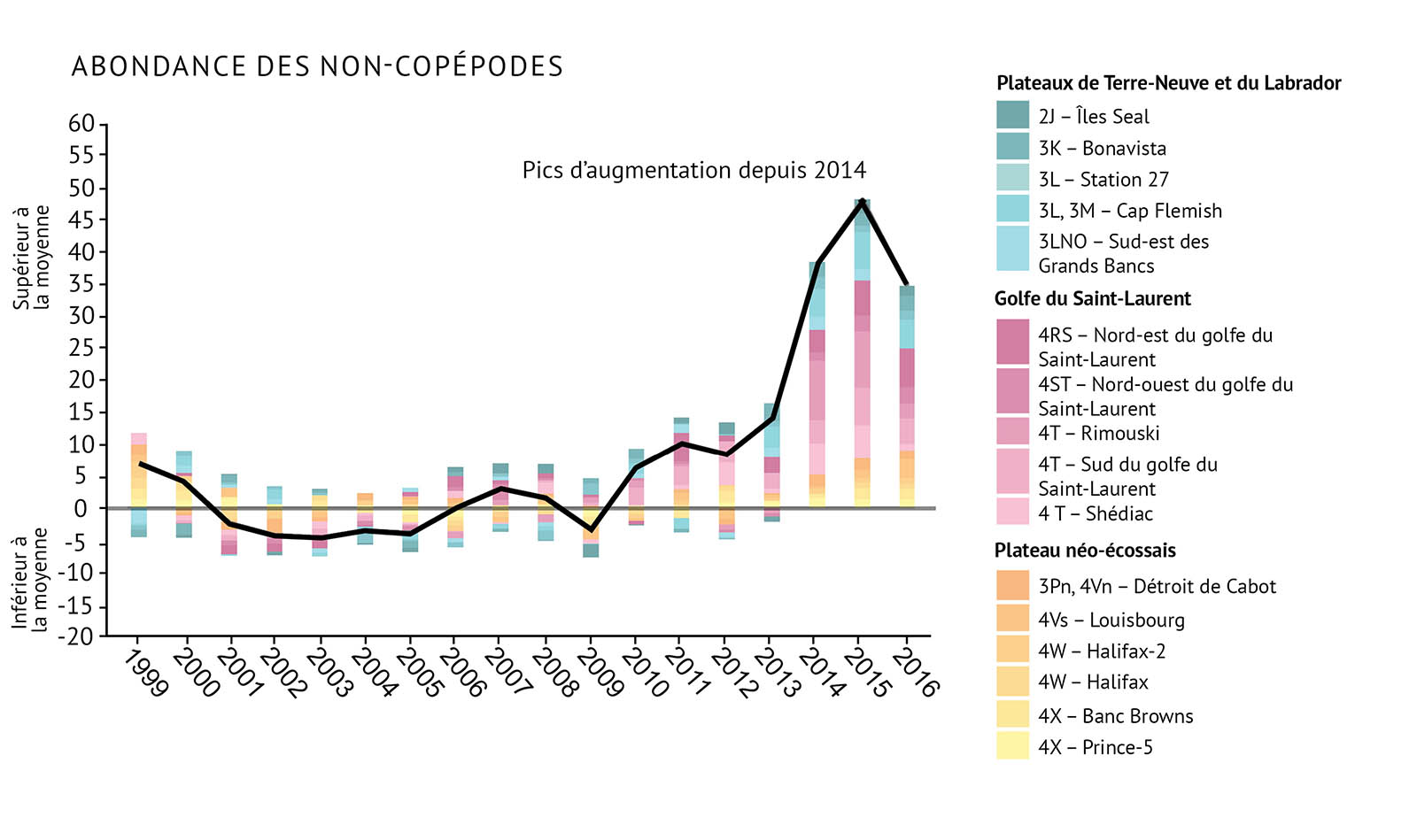
Figure 13 : Observations de l’abondance du zooplancton, y compris des indices pour a) Calanus finmarchicus, b) Pseudocalanus spp., c) le total des espèces de copépodes, et d) les espèces non-copépodes. La ligne noire illustrant les tendances représente les anomalies combinées pour toutes les zones (voir la figure 1 pour prendre connaissance des divisions de l’OPANO).
Liens cruciaux entre le climat et la productivité marine
Le choix du moment est important lorsque vient le temps de considérer la relation entre le phytoplancton, le zooplancton et les poissons fourrage qui s’en nourrissent. Ce moment dépend des conditions climatiques enregistrées durant l’hiver et au printemps.
De petits poissons pélagiques (vivant en eau libre), comme le hareng de l’Atlantique et le capelan, sont des proies importantes pour des prédateurs marins de plus grande taille comme la morue franche, le flétan du Groenland, des oiseaux de mer et des mammifères marins. Ces poissons proies sont également appelés poissons fourrage.
Des études récentes menées sur les plateaux de Terre-Neuve et du Labrador nous ont fourni des éclairages sur la manière dont le climat touche la population de capelans. L’un des principaux facteurs est le moment où la glace de mer fond au printemps, produisant des conditions océaniques qui sont favorables pour la prolifération printanière du phytoplancton. Si la prolifération se produit trop tôt en raison d’un recul précoce de la glace de mer, le zooplancton peut ne pas profiter du moment où la production de phytoplancton est à son maximum. Cela crée une « désynchronisation » dans le flux énergétique et réduit la productivité du zooplancton. Il en résulte une production plus faible de poissons fourrage. La production de capelans et de harengs est directement liée à l’abondance de leurs proies zooplanctoniques. La croissance et le frai du capelan peuvent subir les effets directs d’une piètre production du zooplancton.
En outre, on a montré que la disponibilité du capelan était un facteur important de l’abondance du stock de morues franches du nord et des taux de reproduction des phoques du Groenland.
Ces processus « ascendants » relient les proliférations printanières du phytoplancton à l’abondance du zooplancton et au rendement des poissons fourrage qui ont des incidences sur des organismes qui se trouvent plus haut dans le réseau trophique (figure 14).

Figure 14 : Le recul de la glace au printemps est important pour la création de conditions favorables à la prolifération printanière du phytoplancton. Lorsque le moment du recul de la glace au printemps cause une « désynchronisation » entre les proliférations printanières et le pic de la production du zooplancton, cela entraîne une piètre productivité du zooplancton et des capelans qui s’en nourrissent. Cela a un effet sur la disponibilité de la nourriture pour des espèces qui se situent plus haut dans le réseau trophique.
Battures intertidales
Les battures intertidales sont des milieux dynamiques qui sont submergés par l’eau de mer à marée haute et qui sont exposés à l’air à marée basse. Les diverses tailles des types de sédiments meubles (classés par taille de grain) qui forment ces battures intertidales offrent des habitats à divers organismes marins qui vivent sur et sous la surface. Parmi ces organismes figurent plusieurs espèces de vers, de mollusques, de crustacés, d’oiseaux de rivage et de poissons.
Les battures intertidales sont des habitats qui revêtent une importance sur les plans écologique et économique. Elles constituent d’importants garde-manger pour les oiseaux de rivage résidents et migrateurs et offrent également de fortes densités de myes et de vers qui sont récoltés à des fins commerciales et récréatives. Parmi toutes les battures intertidales qui se trouvent dans l’Atlantique canadien, certaines des plus importantes se situent dans les vasières de la baie de Fundy. Ces vasières soutiennent de fortes densités d’animaux benthiques (qui vivent dans les sédiments) qui, à leur tour, soutiennent la migration de millions d’oiseaux de rivage chaque année. Les conditions environnementales extrêmes peuvent avoir des répercussions sur les organismes marins qui vivent dans les battures intertidales. Parmi ces conditions figurent le réchauffement des températures, l’acidification de l’océan et l’eutrophisation.
Nous devons étudier en même temps l’abondance des organismes et le contenu organique des sédiments, car ces deux facteurs peuvent révéler la présence d’enjeux environnementaux dans les battures intertidales. Des échantillons de sédiments sont prélevés et examinés pour déterminer la taille des grains et la présence de matière organique. On peut prélever des échantillons biologiques en utilisant des carottes d’échantillonnage, des pelles, des pompes sous-marines et des tamis. On utilise ces échantillons pour mesurer la biodiversité et l’abondance des animaux benthiques. Parmi les autres techniques d’échantillonnage figurent la pose de filets pour les poissons, l’utilisation de pièges à fosse pour les animaux vivant au sommet des sédiments et l’enregistrement des observations ou le baguage des oiseaux de rivage. On peut également utiliser des sondes qui enregistrent des paramètres environnementaux comme l’oxygène, le dioxyde de carbone, la température et la salinité pour examiner la chimie des sédiments.
État et tendances
- Le secteur des Sciences du MPO a mené des recherches scientifiques limitées sur les espèces récoltées à des fins commerciales ou récréatives dans les battures intertidales. Cependant, on a également effectué des relevés de la biodiversité locale. Le rôle des diverses espèces qui fréquentent les battures intertidales a été bien étudié par des chercheurs universitaires et par le secteur privé.
- Le MPO ne connaît pas précisément les répercussions écologiques du changement climatique mondial sur les battures intertidales présentant des sédiments mous. Les éléments probants dont nous disposons indiquent que l’augmentation de l’acidité de l’océan et le réchauffement peuvent modifier le comportement de certaines espèces de mollusques et crustacés. Ces facteurs peuvent également causer des lésions aux coquilles et endommager celles-ci, ce qui peut se traduire par une augmentation de la mortalité. Les températures plus chaudes peuvent aggraver certaines maladies des bivalves. Parmi ces maladies figurent la néoplasie hémocytaire, des infections parasitaires et l’intoxication par phycotoxine paralysante. L’acidification et le réchauffement des océans peuvent également avoir une incidence sur le comportement des poissons.
- Les activités humaines comme l’aménagement du littoral, l’agriculture et la foresterie engendrent des menaces supplémentaires pour les organismes qui vivent dans les battures intertidales. Parmi les autres menaces figurent la prédation accrue et la compétition, avec l’arrivée d’espèces aquatiques envahissantes (voir la section sur les espèces aquatiques envahissantes).
Herbiers de zostère
La zostère est constituée de plantes marines à fleurs qui forment de vastes prés sous-marins. La zostère peut tolérer d’importantes fluctuations de la salinité et de la température. Cependant, pour leur photosynthèse et pour établir des systèmes racinaires sains et bien développés leur permettant de survivre, ces plantes ont besoin d’eau limpide et peu profonde. Les herbiers de zostère sont de bons indicateurs de la santé de l’écosystème, car ils répondent rapidement aux conditions environnementales changeantes. Par exemple, la zostère meurt lorsqu’elle est recouverte d’algues nuisibles dans les eaux polluées contenant trop d’éléments nutritifs. En outre, elle meurt rapidement si les températures de l’eau sont trop élevées.
La zostère filtre l’eau, stabilise les sédiments et agit comme zone tampon riveraine. Elle offre également des habitats de croissance et d’alimentation à certaines espèces de poissons commerciaux et récréatifs comme la morue franche et la merluche blanche [voir La zostère : une espèce d’importance écologique]. De petits invertébrés se nourrissent également de bactéries et d’autres organismes croissant sur les limbes de la zostère et dans les sédiments.
Une surveillance étroite des herbiers de zostère peut fournir rapidement des preuves de changement environnemental. On peut cartographier la répartition de la zostère en utilisant la photographie aérienne, l’imagerie par satellite, la télédétection LIDAR et les connaissances locales. On peut mesurer la santé des plantes en dénombrant les pousses, en mesurant la longueur des feuilles ainsi que la biomasse des feuilles et des pousses, et en échantillonnant les composés chimiques des feuilles.
État et tendances
- La zostère est répandue dans toutes les eaux du littoral de l’Atlantique canadien.
- Il s’agit d’une espèce d’importance écologique dans l’Atlantique canadien, en raison de son rôle dans le soutien d’espèces tel que les juvéniles de la morue franche. La perturbation des herbiers aurait de graves conséquences écologiques pour les espèces qu’ils soutiennent.
- L’état de la zostère est variable. Certains herbiers ont décliné ou complètement disparu dans le sud du golfe du Saint-Laurent et sur la côte atlantique de la Nouvelle-Écosse. Ces déclins sont dus à la présence d’éléments nutritifs en excès, au manque d’oxygène, à la sédimentation, à la présence d’espèces envahissantes et au réchauffement. D’autres herbiers se trouvant dans ces régions sont stables, de plus en plus étendus, ou il n’est pas possible de déterminer leur état en raison d’un manque de données.
- On a observé une augmentation de la couverture de la zostère dans la plupart des régions de Terre-Neuve. Ce phénomène est probablement dû au réchauffement des eaux naturellement froides et à une diminution de la glace de mer en hiver, qui ont permis de réduire les dommages. Cependant, cette augmentation de la couverture de la zostère pourrait subir également les conséquences de la propagation et de l’augmentation de l’abondance du crabe vert. On a montré que le crabe vert, une espèce envahissante, réduisait de façon significative la couverture de la zostère dans certaines zones où il s’est établi (voir la section sur les espèces aquatiques envahissantes).
La zostère : une espèce d’importance écologique

Figure 15 : Morues franches d’âge 1 dans un habitat de zostère, détroit de Newman, parc Terra Nova, Terre-Neuve-et-Labrador. Source : groupe des plongeurs du MPO.
Il semble évident que les jeunes poissons qui se trouvent dans des habitats de croissance vont croître, atteindre leur maturité et, en fin de compte, soutenir des populations adultes, y compris ceux qui revêtent une importance pour la pêche commerciale. Cependant, il peut être difficile de relier l’abondance des juvéniles à celle des adultes, car les poissons ont tendance à se déplacer vers des habitats différents au cours de leur croissance. Les morues franches juvéniles, par exemple, se trouvent en fortes densités dans les habitats de végétation côtière, y compris les herbiers marins et les algues. Au fur et à mesure de leur croissance, les morues se répandent et occupent différents habitats côtiers et hauturiers plus profonds et à végétation moins dense qui ne sont pas fréquentés par les poissons plus jeunes. Les variations de l’environnement d’une année à l’autre peuvent également rendre difficiles les comparaisons entre les populations juvéniles et adultes.
La zostère constitue un habitat de croissance côtier très important pour les morues juvéniles (figure 15). Elle est considérée comme une espèce d’importance écologique en raison de l’importance relative de son rôle dans le soutien des habitats côtiers de poissons juvéniles comme les morues franches juvéniles.
Les herbiers de zostère offrent des habitats de croissance parmi les plus productifs au monde. Ils offrent une protection et des aliments pour les morues franches juvéniles, ce qui soutient leur abondance, leur survie et leur croissance.
Durant les 23 dernières années, des recherches sur la zostère et sur la morue ont été menées dans le détroit de Newman, dans la baie Bonavista, à Terre-Neuve-et-Labrador. Ces recherches montrent qu’il existe un lien entre la densité des morues franches d’âge 1 avant qu’elles ne quittent les habitats de croissance que forme la zostère, et les morues pré-adultes qui sont sur le point d’être visées par la pêche commerciale. Les changements dans l’abondance des morues d’âge 1 sont liés à des augmentations et à des diminutions semblables de l’abondance des morues adultes des années plus tard.
Ce lien illustre l’importance des habitats de croissance côtiers comme les herbiers de zostère pour la santé des populations adultes. Des habitats de meilleure qualité produiront davantage de morues juvéniles et, en conséquence, davantage de morues adultes. Ainsi, les facteurs qui sont susceptibles d’avoir un effet négatif sur la zostère, comme la présence de crabe vert, peuvent avoir aussi un effet négatif sur les populations de morues.
Gisements de varech
Le varech est constitué d’espèces d’algues brunes de grande taille qui forment des forêts denses dans les zones infratidales rocheuses et peu profondes. Il a besoin d’eau froide pour prospérer et présente une vulnérabilité particulière aux changements de température. Les eaux plus chaudes réduisent les taux de croissance du varech, peuvent causer sa mort et stimulent la croissance d’espèces envahissantes bioencrasseuses (voir la section sur les espèces aquatiques envahissantes), comme le membranipore européen. Ces invertébrés bioencrasseurs coloniaux forment des croûtes à la surface du varech. Ils peuvent causer des ruptures dans des conditions de vagues déferlantes puissantes en raison d’une fragilité accrue des tissus et limiter la capacité du varech d’effectuer la photosynthèse et de se reproduire. On a attribué la destruction de forêts entières de varech en Nouvelle-Écosse à la propagation et à l’établissement des membranipores.
Les gisements de varech sont très productifs. Les poissons les utilisent pour se nourrir et se protéger contre les prédateurs, et comme aires de croissance. La morue franche, la merluche blanche, le homard d’Amérique, le crabe commun et le crabe nordique sont des espèces de poissons et de crustacés commerciales qui utilisent les gisements de varech durant leurs stades juvéniles ou tout au long de leur vie. Outre le fait qu’ils constituent des habitats essentiels du poisson, les gisements de varech déplacent les matières organiques vers des eaux de mer ouverte plus profondes, ce qui alimente les réseaux trophiques. Le varech joue également un rôle dans le stockage et le cycle du carbone océanique.
On surveille l’état du varech grâce à des données d’observation historiques et à des recherches continues.
État et tendances
- Les cinq espèces principales qui forment le varech (Saccharina latissima, Laminaria digitata, Saccharina nigripes, Alaria esculenta et Agarum cribrosum) ont été observées dans la baie de Fundy et sur la côte atlantique de la Nouvelle-Écosse, tant par le passé (avant 2000) que jusqu’à récemment (après 2000). Dans le sud du golfe du Saint-Laurent et dans l’estuaire du fleuve, ces espèces n’ont été observées que par le passé et ne sont pas fréquemment rencontrées à l’heure actuelle.
- Saccharina latissima est l’espèce de varech dominante en Nouvelle-Écosse, sur la péninsule de Gaspé et dans l’estuaire du Saint-Laurent. Par le passé, elle a atteint un niveau d’abondance très élevé (60 individus par mètre carré) et une biomasse très importante (de cinq à 25 kilogrammes par mètre carré). C’est tout particulièrement le cas dans les zones où des organismes brouteurs, tels que les oursins, sont absents.
- On a observé des déclins des espèces de varechs dans la baie de Fundy et sur la côte atlantique de la Nouvelle-Écosse en raison du réchauffement de l’eau. Les gisements qui se trouvent dans les baies chaudes peu profondes et protégées sont les plus vulnérables. Ces gisements de varech perdus sont remplacés par des algues courtes qui tapissent le fond marin et qui n’offrent pas autant de protection et d’aliments pour les poissons et d’autres organismes que le varech.
- Les gisements de varech qui se trouvent dans les eaux plus froides, plus exposées aux vagues, jouissent habituellement d’une meilleure santé et sont plus stables que les gisements qui se trouvent dans les baies protégées.
Coraux et éponges
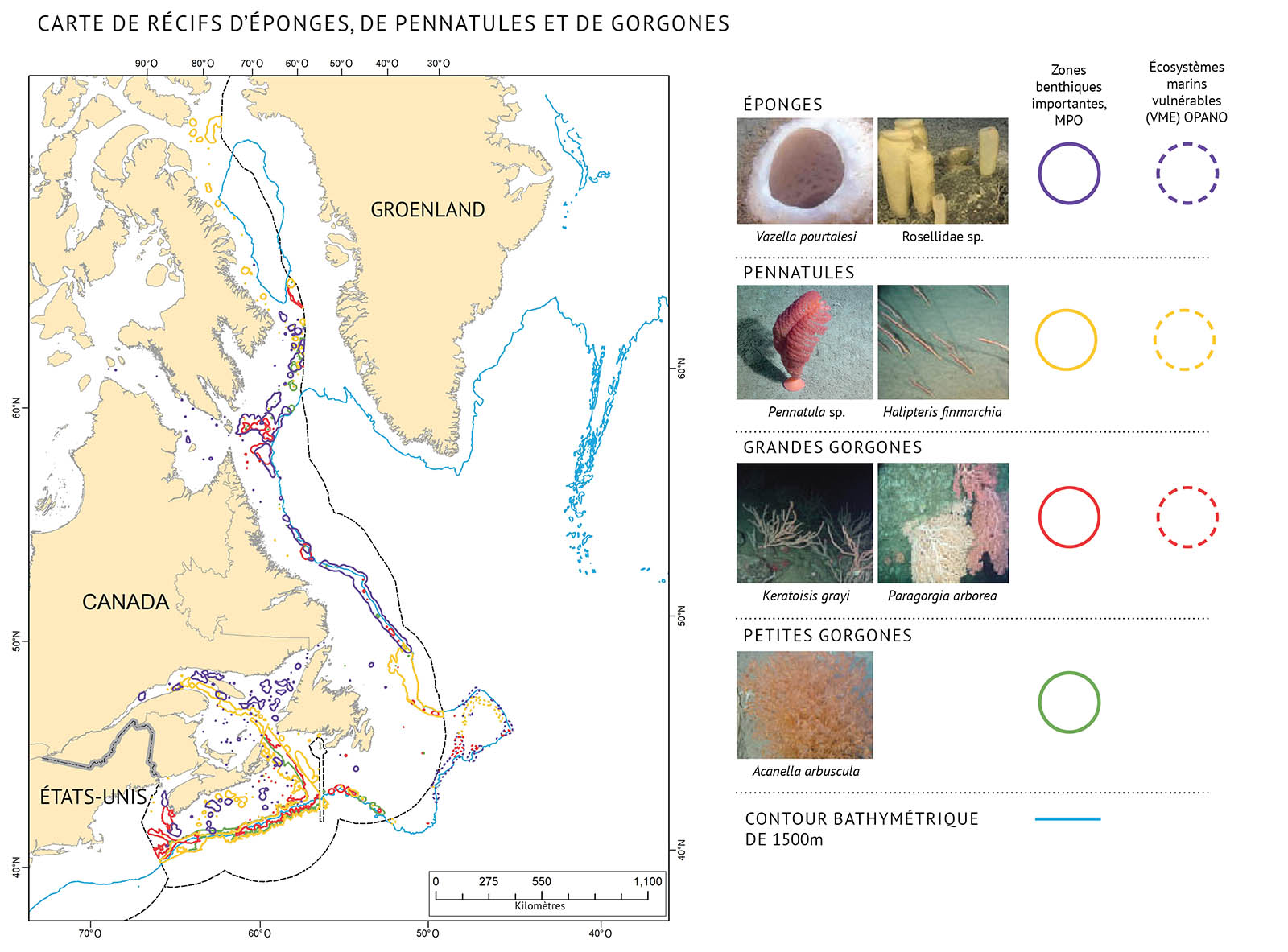
Figure 16 : À gauche : Carte des zones benthiques importantes et des écosystèmes marins vulnérables pour les éponges, les pennatules et les grandes et petites gorgones sur la côte est du Canada. Les zones benthiques importantes sont établies par le MPO dans les limites de la zone économique exclusive de 200 miles marins, tandis que les écosystèmes marins vulnérables se trouvent à l’extérieur de la zone économique exclusive, tel que l’a établi l’OPANO. À droite : Exemples d’éponges, de pennatules et de grandes et petites gorgones que l’on trouve dans l’Atlantique canadien. Les coraux et les éponges ont tendance à se répartir dans les eaux froides le long des bords du plateau continental, jusqu’à une profondeur de 3 000 mètres. Ils sont très vulnérables aux activités humaines.
Les coraux croissent principalement sur des fonds stables comme ceux qui sont formés de blocs et de substrat rocheux, mais peuvent également s’ancrer dans des sédiments mous. La répartition des coraux dans les eaux profondes est inégale et dépend des conditions du plancher océanique, de la température, de la salinité et des courants. On trouve les éponges le long des plateaux, des pentes et des canyons continentaux ainsi que dans les fjords profonds, à des profondeurs pouvant aller jusqu’à 3 000 mètres (figure 16). Les coraux et les éponges d’eau profonde sont très vulnérables aux activités humaines comme la pêche et l’extraction des ressources. Les coraux peuvent également être vulnérables aux effets du changement climatique, car certaines espèces ne peuvent survivre qu’à certaines températures.
Les coraux et les éponges pourraient être les seuls éléments formant des habitats complexes sur le plancher océanique. Ces habitats figurent parmi les zones les plus riches en espèces dans les écosystèmes marins d’eau profonde. Leur structure offre des zones où d’autres espèces peuvent se reposer, s’alimenter, frayer et éviter les prédateurs. Elle peut également offrir une protection pour les œufs et les juvéniles de diverses espèces. Les éponges contribuent de façon importante aux cycles de l’azote, du carbone et du silicium dans l’océan. Cela résulte de leur grande capacité d’alimentation par filtrage, de leur régime alimentaire principalement composé de matières organiques dissoutes et de leur squelette silicifié.
Avant 2000, on connaissait la répartition des coraux d’après les déclarations de prises accidentelles des pêcheurs de poissons. Depuis lors, des chercheurs du MPO, des collègues du milieu universitaire, des environnementalistes et des pêcheurs ont collaboré à la réalisation de relevés de recherche en haute mer à l’aide de chaluts et de véhicules sous-marins téléguidés pour que l’on puisse améliorer nos connaissances sur la répartition des coraux et des éponges.
État et tendances
- Les coraux et les éponges qui se trouvent dans les eaux de l’Atlantique ne sont pas bien documentés. Environ 40 espèces de coraux de l’est du Canada sont connue, mais on effectue encore de nouvelles découvertes. Au cours de relevés au chalut menés récemment dans le détroit de Davis, situé au nord des plateaux de Terre-Neuve et Labrador, on a identifié 94 espèces d’éponges, dont trois étaient encore inconnues des chercheurs.
- Le seul récif corallien connu dans l’Atlantique canadien est formé par le Lophelia pertusa, un corail de pierre qui forme des récifs. Il se trouve à une profondeur d’environ 300 mètres sur le plateau néo-écossais.
- Dans le golfe du Saint-Laurent, on trouve des groupes denses de pennatules, qui forment des habitats pour d’autres espèces.
- Dans bon nombre de secteurs, les éponges sont de loin les organismes dominants du fait de leur abondance (jusqu’à 16 individus par mètre carré) et de leur biomasse (plus de 90 % de la biomasse des invertébrés totaux).
Gisements de clypéastres

Figure 17 : Répartition du clypéastre dans la biorégion du plateau néo-écossais d’après le relevé plurispécifique au chalut du MPO (1999–2015) et du relevé d’évaluation des stocks de pétoncles (1997, 2007). Les clypéastres sont particulièrement abondants dans la baie de Fundy, sur l’est du plateau néo-écossais, sur le banc Georges, dans le golfe du Saint-Laurent et sur les Grands Bancs. (Reproduit avec la permission de Beazley et al., 2017).
Dans l’est du Canada, le clypéastre commun (Echinarachnius parma) forme des groupes denses qui sont appelés des gisements et qui sont présents depuis les eaux intertidales peu profondes jusqu’aux plateaux continentaux extracôtiers (figure 17). Contrairement à ce qu’indique leur nom en anglais (« sand dollars »), les clypéastres se trouvent dans un éventail de types de sédiments, depuis le sable grossier et pierreux jusqu’au limon fin. Ils se nourrissent de diatomées benthiques (algues), de particules organiques et d’autres particules de petite taille, tout en creusant à l’aide de petits tentacules.
Les clypéastres sont une espèce clé dans l’Atlantique en raison du fait qu’ils sont des « bioturbateurs » – Ils perturbent et mélangent rapidement les sédiments lorsqu’ils se nourrissent et s’enfouissent. Ces comportements entraînent la pénétration d’oxygène en quantité plus importante plus profondément dans les sédiments, ce qui permet à davantage d’organismes d’y vivre. Sur le plateau néo-écossais, les clypéastres contribuent de façon importante à la perturbation des sédiments sur le plancher océanique (le deuxième en importance après les tempêtes). Les clypéastres peuvent se rassembler en groupes denses (jusqu’à 180 par mètre carré sur le banc de l’Île de Sable), certains d’entre eux ayant été considérés dans la détermination de zones d’importance écologique et biologique.
Des données sur la répartition des clypéastres ont été recueillies durant des relevés plurispécifiques au chalut, certains relevés menés pour l’évaluation des stocks de pétoncles et la réalisation de recherches ciblées.
État et tendances
- Les clypéastres sont particulièrement abondants dans la baie de Fundy, sur l’est du plateau néo-écossais, sur le banc Georges, dans le golfe du Saint-Laurent et sur les Grands Bancs.
- Les populations non perturbées de clypéastres affichent une variabilité de leur abondance au fil du temps, mais les emplacements des gisements sont stables à des échelles spatiales plus vastes.
- Les clypéastres sont menacés par le chalutage par le fond : une étude menée sur les Grands Bancs a permis de relever une diminution de 37 % de la population immédiatement après le chalutage. Mais, comme ces animaux fraient plus d’une fois par an, la population peut se rétablir, au moins dans des parties de son aire de répartition.
Communautés de poissons et d’invertébrés
Les communautés de poissons et d’invertébrés marins pélagiques (en haute mer), démersaux (près du fond) et benthiques (au fond) font partie d’un réseau écologique complexe. Ces communautés sont étroitement liées à l’environnement physique, chimique et biologique dans lequel elles évoluent. Selon leur régime alimentaire, les poissons et les invertébrés se situent à différents niveaux du réseau trophique et jouent un rôle important dans le transfert de l’énergie et des éléments nutritifs le long de la chaîne alimentaire, depuis les producteurs, comme les plantes, jusqu’aux consommateurs, comme les humains. Un changement dans la structure d’une communauté marine peut avoir une incidence considérable sur la santé d’autres communautés.
Les poissons et les invertébrés (crustacés et mollusques) sont d’importantes sources de nourriture pour les Canadiens et figurent parmi les plus importants aliments exportés par le Canada. Nous devons disposer de données scientifiques sur la situation des communautés de poissons et d’invertébrés et sur les tendances qu’ils affichent si nous voulons prendre des décisions de gestion durables et responsables pour conserver la ressource tout en assurant l’avenir de nos pêches.
Les pêches ciblent des espèces particulières, et les captures effectuées nous offrent de l’information utile aux fins de gestion, mais les prises ne reflètent pas toutes les communautés de l’écosystème marin. Pour compenser, les chercheurs réalisent des relevés scientifiques afin de recueillir des données supplémentaires et de fournir de l’information sur davantage de communautés marines. L’évaluation de la situation des communautés de poissons et d’invertébrés marins exige une surveillance attentive et des analyses scientifiques.
État et tendances – biorégion de l’Atlantique
- À la fin des années 1980 et au début des années 1990, les trois biorégions de l’Atlantique ont connu l’effondrement de plusieurs populations de poissons démersaux, y compris d’espèces commerciales d’importance historique, comme la morue franche. On estime que ces déclins sont en très grande partie attribuables à la surpêche et à des conditions environnementales défavorables; dans certains secteurs, le rétablissement a été entravé par la prédation par les phoques [voir C’est compliqué : les phoques et la morue franche].
- Au même moment, les populations d’invertébrés benthiques ont commencé à croître, probablement en partie sous l’effet d’une diminution de la prédation par des poissons démersaux et de conditions environnementales plus froides. Le crabe des neiges et la crevette nordique ont augmenté en nombre dans toutes les biorégions, et sont devenus des espèces commerciales importantes.
- Récemment, certaines populations de poissons démersaux (morue franche) ont affiché des augmentations modestes dans certaines zones, mais se situent toujours loin de leur abondance historique. Les espèces d’invertébrés qui ont profité des conditions plus froides dans les années 1990 diminuent maintenant en nombre tandis que des conditions plus chaudes se font sentir dans l’ensemble de la biorégion.
- Les tendances récentes au réchauffement observées dans la zone de l’Atlantique sont liées à des changements dans la répartition des espèces, y compris le déplacement dans de nouvelles zones, l’occupation de zones plus vastes et l’augmentation de l’abondance des espèces qui préfèrent des eaux plus chaudes, y compris des invertébrés côtiers comme le homard d’Amérique. Des espèces démersales, qui n’étaient pas importantes par le passé, comme le merlu argenté, deviennent plus abondantes dans certains secteurs et pourront jouer, à l’avenir, un rôle plus important dans les écosystèmes de l’Atlantique.
C’est compliqué : les phoques et la morue franche
Au début des années 1990, on a assisté à un effondrement généralisé des stocks de morues franches au large de la côte est du Canada. Les raisons soupçonnées de cet effondrement étaient variables : surpêche, prises non déclarées, déclin de la productivité, mortalité naturelle élevée en raison de piètres conditions océaniques et prédation accrue.
On dénombre sept stocks de morues franches dans l’Atlantique canadien (figure 18). Certains de ces stocks semblent se rétablir lentement. D’autres demeurent à de faibles niveaux ou continuent de décliner, même si des mesures de gestion strictes sont en place pour limiter l’effort de pêche. En même temps, les populations de phoques du Groenland et de phoques gris ont augmenté, atteignant des nombres jamais enregistrés au cours des 50 dernières années (figure 19). Cette situation a mené à la conclusion que le non-rétablissement de la morue franche et d’autres populations de poissons démersaux serait dû à une surabondance des populations de phoques, qui se nourrissent de grandes quantités de poissons.
La recherche a montré que les facteurs qui influent sur le rétablissement de la morue franche sont complexes. Le rôle de la prédation par les phoques, ainsi que d’autres facteurs, diffèrent selon les biorégions. On trouvera ci-après des exemples de ces différences par stock régional de morues.
Les stocks de morues franches que l’on trouve au large de la côte nord-est de Terre-Neuve (divisions 2J3KL) ont vu leur abondance augmenter entre 2005 et 2016, malgré la présence d’une importante population de phoques du Groenland. Cependant, ils sont encore loin des niveaux historiques ou de l’effectif qui est requis si l’on veut conserver l’espèce. Au cours d’une étude récente, on a montré que la pêche et la disponibilité limitée de capelans expliquaient le lent rétablissement de la morue. La consommation par les phoques n’a pas été jugée comme une cause importante du déclin ou de la lenteur du rythme de rétablissement.
Dans le nord du golfe du Saint-Laurent (divisions 4RS/3Pn), le stock de morues montre également des signes de rétablissement, mais à un rythme lent. Les chercheurs qui étudient les différentes causes possibles – la pêche, les conditions environnementales et la prédation – estiment que la très faible survie des jeunes morues serait la cause principale. Une combinaison de la surpêche, de la prédation par les phoques du Groenland et de températures froides de l’eau enregistrées durant les années 1990 seraient les principaux facteurs de ce faible taux de survie.
Dans le sud du golfe (division 4T), les grosses morues continuent de décliner, et la mortalité extrêmement élevée chez les poissons matures empêche le rétablissement du stock. Compte tenu des taux élevés de mortalité actuels, les morues pourraient disparaître de cette région d’ici une quarantaine d’années. À cet endroit, les chercheurs considèrent que la prédation par le phoque gris est importante et pourrait expliquer jusqu’à 50 pour cent de la mortalité de la morue, bien que d’autres facteurs puissent également être en jeu.

Figure 18 : Emplacement des stocks de morues dans l’Atlantique canadien. Parmi les sept stocks de morues franches de l’Atlantique canadien, certains semblent se rétablir lentement, tandis que d’autres demeurent à de faibles niveaux ou continuent de décliner. L’importance de la surpêche, des conditions environnementales, de la disponibilité du capelan et de la prédation par les phoques diffèrent selon les biorégions.
Golfe du Saint-Laurent
Deux principaux relevés de recherche scientifique sont menés chaque année dans des zones différentes de la biorégion du golfe du Saint-Laurent. La biorégion est ainsi évaluée en fonction de deux sous-régions : le nord du golfe (divisions 4R et 4S) et le sud du golfe (division 4T). On a commencé à effectuer un relevé annuel en septembre dans le sud du golfe en 1971. Puis, en 1990, un relevé du mois d’août a été lancé pour l’estuaire du fleuve et le nord du golfe. Ces relevés reposent sur l’utilisation de chaluts du fond pour collecter des données sur les espèces présentes et sur leur abondance.
Les chaluts de fond ne constituent pas une méthode idéale pour évaluer les espèces de poissons pélagiques, car celles-ci vivent en eau libre. En conséquence, des relevés ciblés ont été menés pour certains stocks pélagiques comme ceux du hareng de l’Atlantique. En ce qui concerne les autres espèces qui ne font pas l’objet de relevés ciblés, on peut utiliser les débarquements dans la pêche commerciale pour mieux comprendre l’état de ces stocks. Lorsqu’ils utilisent ce type de données, les chercheurs doivent garder à l’esprit que l’ampleur de l’effort de pêche peut avoir une incidence sur les débarquements. En conséquence, ils doivent faire preuve de prudence lorsqu’ils effectuent des comparaisons avec les données dérivées des relevés de recherche.
État et tendances – golfe du Saint-Laurent
- Au début des années 1990, on a observé un déclin marqué de la communauté des poissons démersaux, notamment des morues franches, et ce dans l’ensemble de la biorégion du golfe (figure 20, figure 21). On pense que la surpêche et la présence d’un environnement plus froid ont joué un rôle dans cet effondrement. Cette situation a mené à d’importants changements dans la composition des communautés de poissons.
- Dans le nord du golfe, le flétan du Groenland, une espèce de poisson d’eau profonde, était la seule espèce à avoir augmenté en nombre durant les années 1990. Plus récemment, l’espèce a décliné. La morue franche, qui a vu son abondance augmenter lentement après 2000, a de nouveau décliné en 2017. Il est important de noter que d’autres espèces de poissons démersaux (le sébaste et le flétan de l’Atlantique) ont augmenté en nombre depuis 2010.
- Dans le sud du golfe, les poissons démersaux, comme la morue franche et la plie canadienne, sont demeurés à de faibles niveaux ou ont continué de décliner durant les dernières années en dépit d’une faible activité de pêche. La prédation exercée par les phoques gris a joué un rôle dans la limitation du rétablissement de la morue franche [voir C’est compliqué : les phoques et la morue franche]. Au cours des dernières années, seules quelques espèces de poissons démersaux comme le sébaste et le flétan de l’Atlantique ont affiché une augmentation modeste.
- Certaines espèces pélagiques du sud du golfe, notamment le hareng de l’Atlantique, ont commencé à augmenter en nombre durant les années 1980 (figure 22). Ce phénomène, combiné au déclin des espèces démersales, a mené à des changements importants des communautés de poissons. Récemment, le hareng de l’Atlantique a commencé à décliner dans toute la biorégion du golfe, peut-être en raison de piètres conditions environnementales (figure 22, figure 23).
- Le maquereau, qui fait partie d’une population plus importante de la côte est, affiche de faibles niveaux dans l’ensemble de la biorégion (figure 23). S’étant quelque peu rétabli durant les années 2000 après les déclins enregistrés dans les années 1990, le stock de maquereau s’est effondré en 2010 en raison de la surpêche. Le capelan est une espèce pélagique commerciale importante dans le nord du golfe. Bien qu’il n’y ait pas de relevé ciblant le capelan, on a observé une diminution récente des débarquements dans la pêche commerciale.
- L’abondance des invertébrés benthiques a également changé avec l’effondrement des populations de poissons démersaux (figure 24, figure 25). Cependant, le réchauffement récent et la prédation accrue exercée par l’augmentation des espèces démersales comme le sébaste ont entraîné des déclins des populations d’invertébrés benthiques. Dans le nord du golfe, la crevette nordique, qui a augmenté en nombre durant les années 1990, a diminué depuis 2005 (figure 26). Dans le nord et dans le sud, les populations de crabes des neiges ont tendance à diminuer puis à augmenter, mais peuvent subir les répercussions négatives des tendances au réchauffement.
- Le homard d’Amérique a vu son abondance augmenter dans l’ensemble de la biorégion, à la faveur de conditions plus chaudes. Cette augmentation, combinée à la pratique de nouvelles pêches durant les années 1980, a causé un bond des débarquements d’invertébrés dans le nord du golfe (figure 24, figure 25).
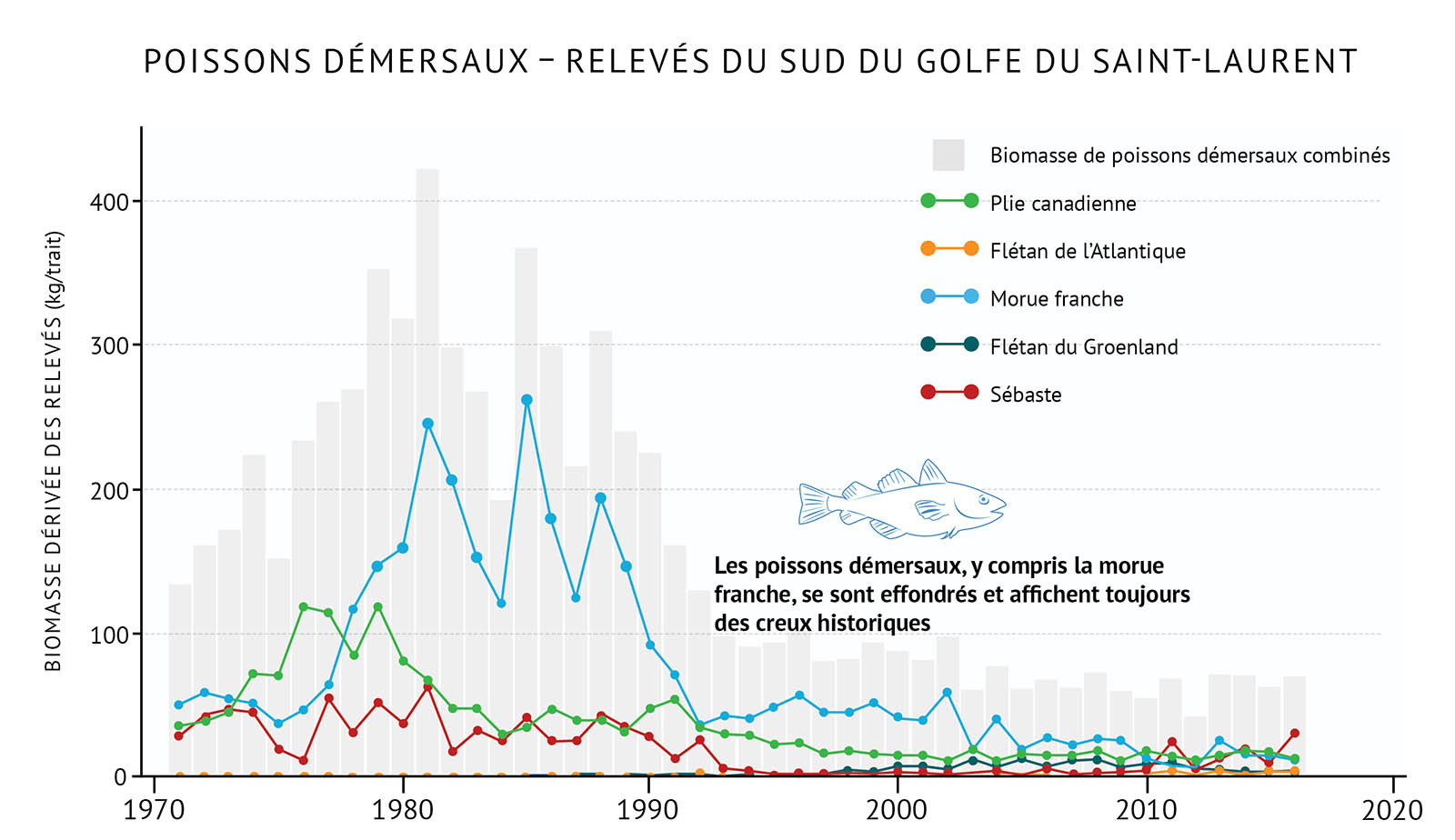
Figure 20 : Biomasse totale dérivée des relevés des poissons démersaux et d’espèces individuelles dans le sud du golfe du Saint-Laurent.

Figure 21 : Biomasse totale dérivée des relevés des poissons démersaux et d’espèces individuelles dans le nord du golfe du Saint-Laurent.
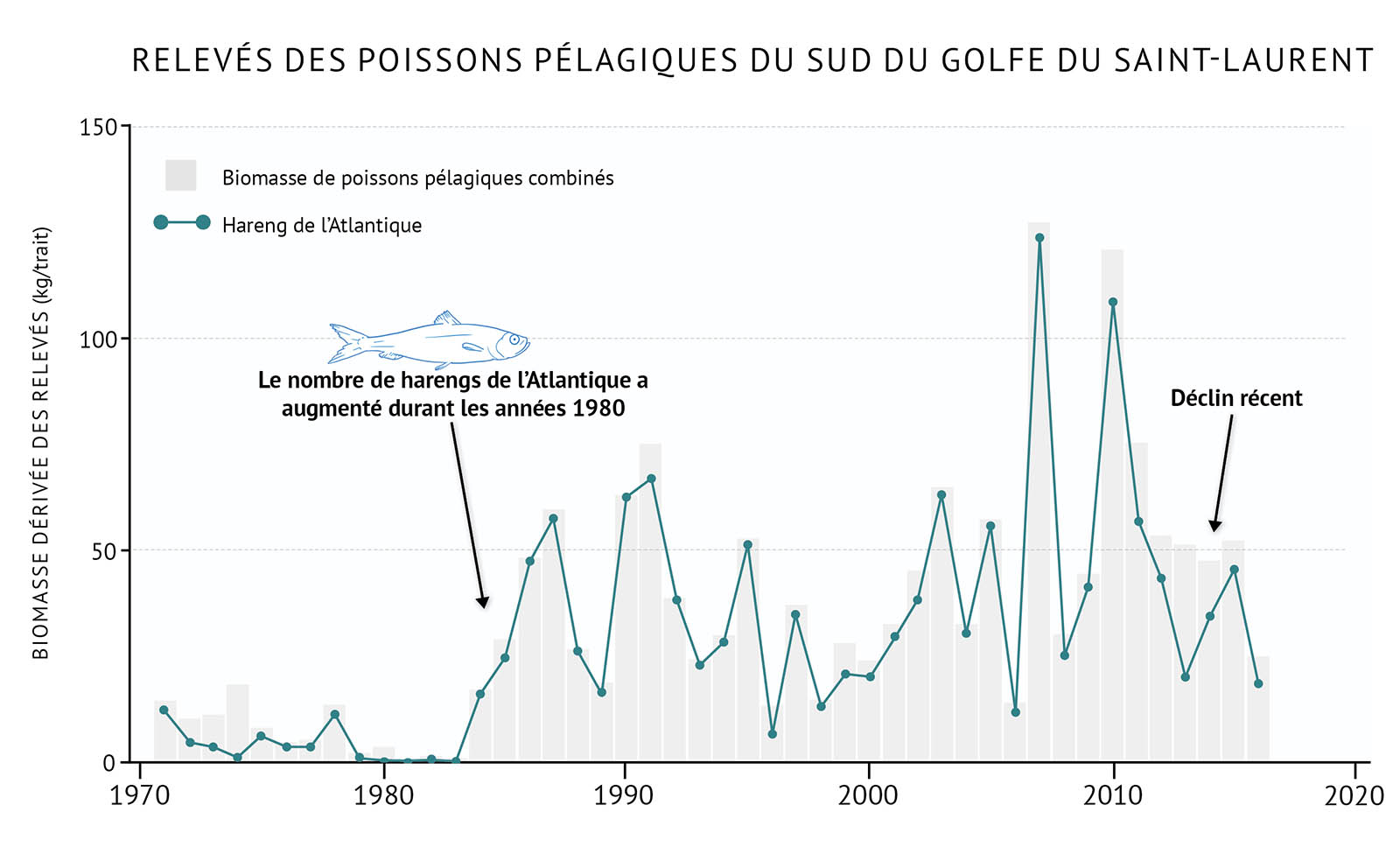
Figure 22 : Biomasse totale dérivée des relevés des poissons pélagiques et du hareng de l’Atlantique dans le sud du golfe du Saint-Laurent.

Figure 23 : Biomasse totale dérivée des relevés des poissons pélagiques et d’espèces individuelles dans le nord du golfe du Saint-Laurent.

Figure 24 : Biomasse dérivée des relevés des invertébrés benthiques, du homard d’Amérique et du crabe des neiges dans le sud du golfe du Saint-Laurent.

Figure 25 : Débarquements dans la pêche commerciale d’invertébrés benthiques et d’espèces individuelles dans le nord du golfe du Saint-Laurent. Parmi les nouvelles pêches figure celle à l’oursin vert, au concombre de mer et à la mactre de Stimpson. D’autres espèces traditionnellement exploitées comprennent le crabe commun, le crabe araignée, le pétoncle géant, le buccin, la mye commune, le couteau de l’Atlantique et la mactre de l’Atlantique.
Plateau Néo-Écossais
Pour les fins de la description des communautés de poissons et d’invertébrés, on divise le plateau néo-écossais en deux grandes sous-régions : l’est du plateau néo-écossais (divisions 4W et 4V) et l’ouest du plateau néo-écossais et la baie de Fundy (division 4X). Les relevés par navire scientifique reposent sur l’utilisation de chaluts de fond pour évaluer les communautés de poissons et d’invertébrés dans cette biorégion, bien que l’on utilise aussi les débarquements dans la pêche commerciale pour ajouter des données.
État et tendances – plateau Néo-Écossais
- On a observé un changement considérable dans l’écosystème de l’est du plateau néo-écossais durant la fin des années 1980 et le début des années 1990. Ce changement résultait de déclins très importants des poissons démersaux, après des années de pression élevée de la pêche et le début de conditions plus froides (figure 27, figure 28). Les stocks de morues franches se sont effondrés, tandis que les sébastes, les aiglefins, les merluches blanches, les goberges, et les raies épineuses ont tous décliné de façon considérable.
- Dans la division 4X, les déclins étaient moins importants, et la biomasse des poissons démersaux totaux ne présentait aucune tendance à long terme dans cette région.
- On a observé également des changements très marqués chez les espèces de poissons pélagiques. Le hareng de l’Atlantique, qui soutenait une pêche importante sur l’ouest du plateau néo-écossais, s’est effondré durant la fin des années 1980 et le début des années 1990 et continue de décliner (figure 29).
- Au contraire, des invertébrés benthiques comme la crevette nordique et le crabe des neiges étaient favorisés par les conditions plus froides qui ont prévalu au début des années 1990. Les débarquements dans la pêche commerciale n’ont cessé d’augmenter depuis les années 1970 (figure 30).
- De façon générale, la biomasse des poissons démersaux est demeurée faible, mais variable, dans l’est, et la morue franche ne s’est pas rétablie. Récemment, la biomasse de certaines espèces démersales comme l’aiglefin de la division 4X et le merlu argenté du plateau néo-écossais a augmenté, tandis que la biomasse du sébaste de la division 4X et du flétan de l’Atlantique du plateau néo-écossais se situent aux plus hauts niveaux observés.
- Le réchauffement récent des eaux a entraîné des déclins chez des espèces comme la crevette nordique et le crabe des neiges, qui préfèrent des eaux plus froides. Le homard d’Amérique, qui préfère des températures plus chaudes, augmente rapidement en nombre sur le plateau néo-écossais et étend son aire de répartition plus loin vers l’est (division 4W) et dans des eaux plus profondes (figure 30).
- Le réchauffement récent a également favorisé l’arrivée de nouvelles espèces le long du plateau néo-écossais. Tandis que certaines de ces espèces « exotiques » ne sont capturées qu’occasionnellement durant les relevés annuels, elles semblent être là pour rester [voir Nouvelles espèces d’eau chaude].

Figure 27 : Biomasse totale dérivée des relevés des poissons démersaux et d’espèces individuelles dans les divisions 4VW (est du plateau néo-écossais).
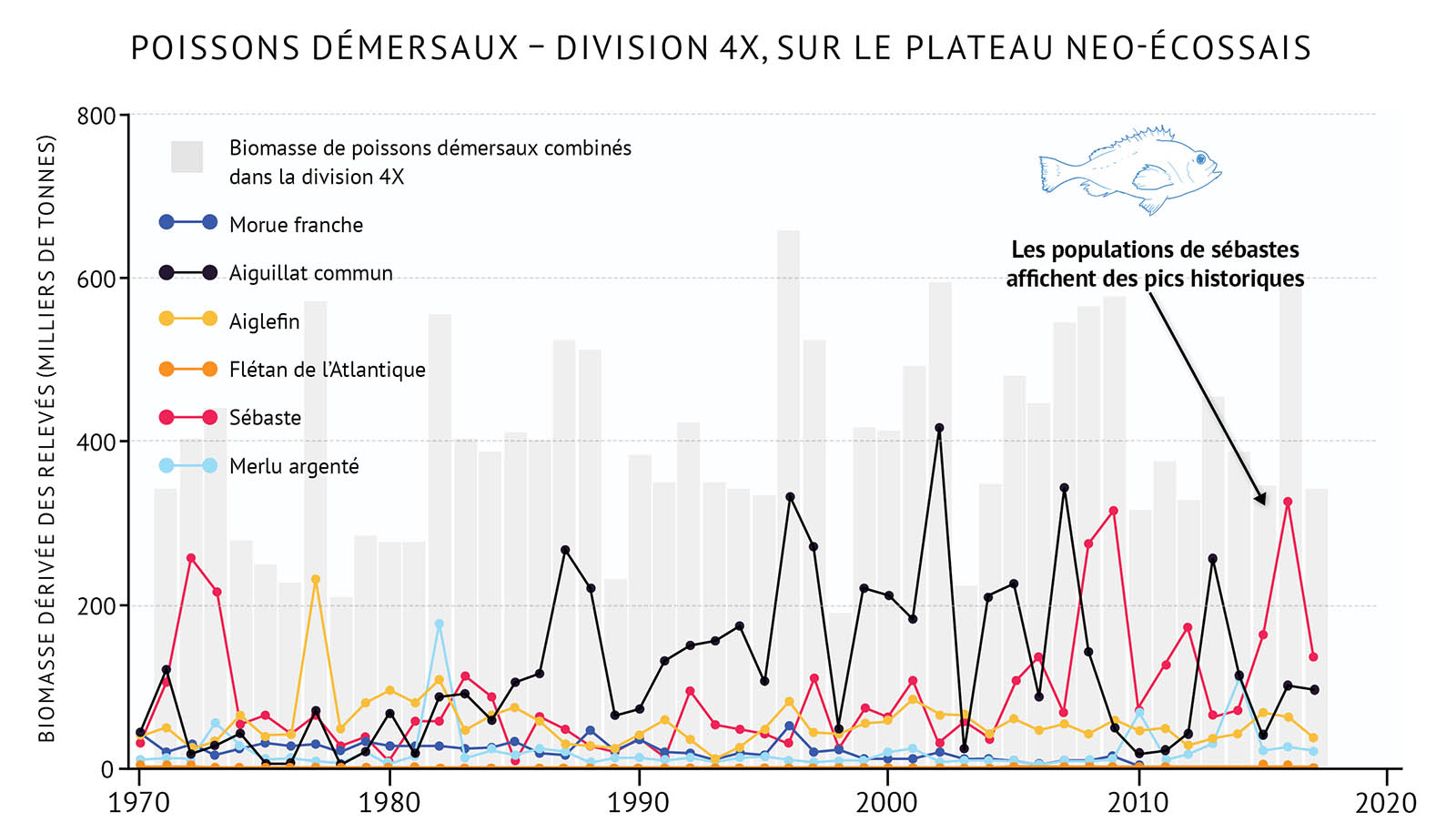
Figure 28 : Biomasse totale dérivée des relevés des poissons démersaux et d’espèces individuelles dans la division 4X (ouest du plateau néo-écossais et baie de Fundy).

Figure 30 : Débarquements commerciaux d’espèces d’invertébrés benthiques et biomasse dérivée des relevés d’espèces d’invertébrés benthiques individuelles pour le plateau néo-écossais. Les débarquements commerciaux affichent une tendance à long terme à la hausse. La collecte de données grâce aux relevés de recherche a débuté en 1999.
Nouvelles espèces d’eau chaude
Les relevés qui ont servi à surveiller les conditions environnementales et les populations de poissons au large de la côte atlantique au cours des dernières années ont ménagé quelques surprises : un nombre croissant d’espèces de poissons d’eau chaude, dont certaines ont été régulièrement capturées plus loin au sud, sur le banc George, sont maintenant plus fréquemment observées sur le plateau néo-écossais.
La température moyenne des eaux du fond du plateau néo-écossais et de la baie de Fundy est de 6,8 ℃ en été. Cette température varie d’une année à l’autre, les températures les plus chaudes ayant été relevées au cours des six dernières années. Les prises effectuées au chalut de fond durant les relevés d’été annuels ont permis de recenser différentes espèces selon la température (figure 31). Certaines espèces, comme la grande raie, ne sont pas régulièrement capturées.
Au cours des cinq dernières années, cependant, le nombre d’espèces d’eau chaude exotiques capturées a augmenté. Il en va de même pour la fréquence à laquelle ces espèces étaient capturées. Les prises de saint-pierres, du malarmat à dix aiguillons, du ‘spotted tinselfish’ et du sanglier à corps élevé sont beaucoup plus fréquentes (figure 32). Certaines espèces, comme la chèvre impériale, semblent être là pour rester. Ces poissons sont capturés chaque année sur le plateau néo-écossais, et leur aire de répartition s’étend au fur et à mesure que le fond de l’océan se réchauffe.

Figure 31 : Répartition par décennie des captures d’espèces de poissons d’eau chaude qui se superpose à la température moyenne pour chaque période de temps. Les points noirs représentent des relevés dans lesquels était présente au moins une espèce de poissons d’eau chaude. Récemment, le nombre et la fréquence d’espèces d’eau chaude capturées ont augmenté.
Figure 32 : Variétés de poissons « exotiques » capturés sur le plateau néo-écossais : a) malarmat à dix aiguillons (Peristedion miniatum), b) callionyme à nageoire tachetée (Foetorepus agassizii), c) vivaneau (Heteropriacanthus cruentatus), d) sanglier à corps élevé (Antigonia capros) et e) saint-pierre (Zenopsis ocellata) (partiel). (Photo : W. Joyce, MPO)
Plateaux de Terre-Neuve et du Labrador
La biorégion des plateaux de Terre-Neuve et du Labrador peut être considérée comme comprenant quatre grands écosystèmes fonctionnels, des données à long terme étant disponibles pour trois d’entre eux : le plateau de Terre-Neuve (divisions 2J3K), le Grand Banc (divisions 3LNO) et le sud de Terre-Neuve (division 3Ps). Les stocks de poissons et d’invertébrés sont surveillés grâce à des relevés de recherche au chalut, qui sont menés au printemps et à l’automne de chaque année. Les relevés de printemps couvrent la zone qui s’étend du sud de Terre-Neuve (division 3P) au Grand Banc (divisions 3LNO). Les relevés d’automne couvrent les plateaux de Terre-Neuve et du Labrador entre les divisions 2H et 3NO. Le type d’engin utilisé durant les relevés a changé à l’automne 1995, de sorte qu’on a ajusté les données pour rendre possibles des comparaisons.
Comme les chaluts de fond ne permettent pas de brosser un tableau complet des poissons pélagiques, on effectue parfois des relevés ciblés. Par exemple, on a évalué le capelan dans la division 3L en utilisant des méthodes de relevé acoustiques.
État et tendances – plateaux de Terre-Neuve et du Labrador
- La forte pression de la pêche qui s’est exercée durant les années 1960 et 1970, suivie par des conditions environnementales défavorables, ont entraîné un changement brusque de la structure des communautés à la fin des années 1980 et au début des années 1990. Ce changement était plus marqué et plus précoce dans le nord (divisions 2J3K), et un peu moins prononcé dans le sud (divisions 3LNO) (figure 33, figure 34).
- Les espèces commerciales et non commerciales de poissons démersaux et pélagiques ont vu leur nombre chuter à la fin des années 1980. Cela comprenait l’effondrement éventuel du stock de morues franches du nord [voir C’est compliqué : les phoques et la morue franche]. Le capelan, une espèce pélagique clé, s’est effondré en 1991 et doit encore se rétablir pour atteindre ses niveaux antérieurs (figure 35).
- Les populations d’invertébrés benthiques, comme la crevette nordique et le crabe des neiges, ont vu leur abondance augmenter à la fin des années 1980 et au début des années 1990 (figure 36, figure 37). Cela résultait de conditions environnementales froides, combinées avec une diminution de la pression de la prédation par les poissons démersaux.
- À la fin des années 1990 et au début des années 2000, peu de changements se sont produits dans l’abondance des poissons démersaux et pélagiques, tandis que les invertébrés benthiques sont demeurés à des niveaux élevés. Les pêches à la crevette nordique et au crabe des neiges sont devenues dominantes dans cette région.
- Au milieu des années 2000, des conditions environnementales plus chaudes, de pair avec des augmentations modestes du nombre de capelans, ont mené à une augmentation de l’abondance des poissons démersaux et à un déclin des invertébrés benthiques. La biomasse globale des poissons démersaux et pélagiques se situe encore bien en deçà des niveaux enregistrés avant l’effondrement de ces espèces. La biomasse totale des poissons démersaux et pélagiques dans ces écosystèmes a montré des signes de productivité faible depuis le milieu des années 2010 et, dans certains cas, des signes de déclin.
- Des espèces d’eau plus chaude comme le merlu argenté deviennent dominantes dans certains secteurs (figure 38). Cela pourrait indiquer les types de changements qui seront observés avec le changement climatique.

Figure 33 : Biomasse des espèces de poissons démersaux dérivée des relevés d’automne dans les divisions 2J3K, sur les plateaux de Terre-Neuve et du Labrador, de pair avec la biomasse d’espèces démersales individuelles.
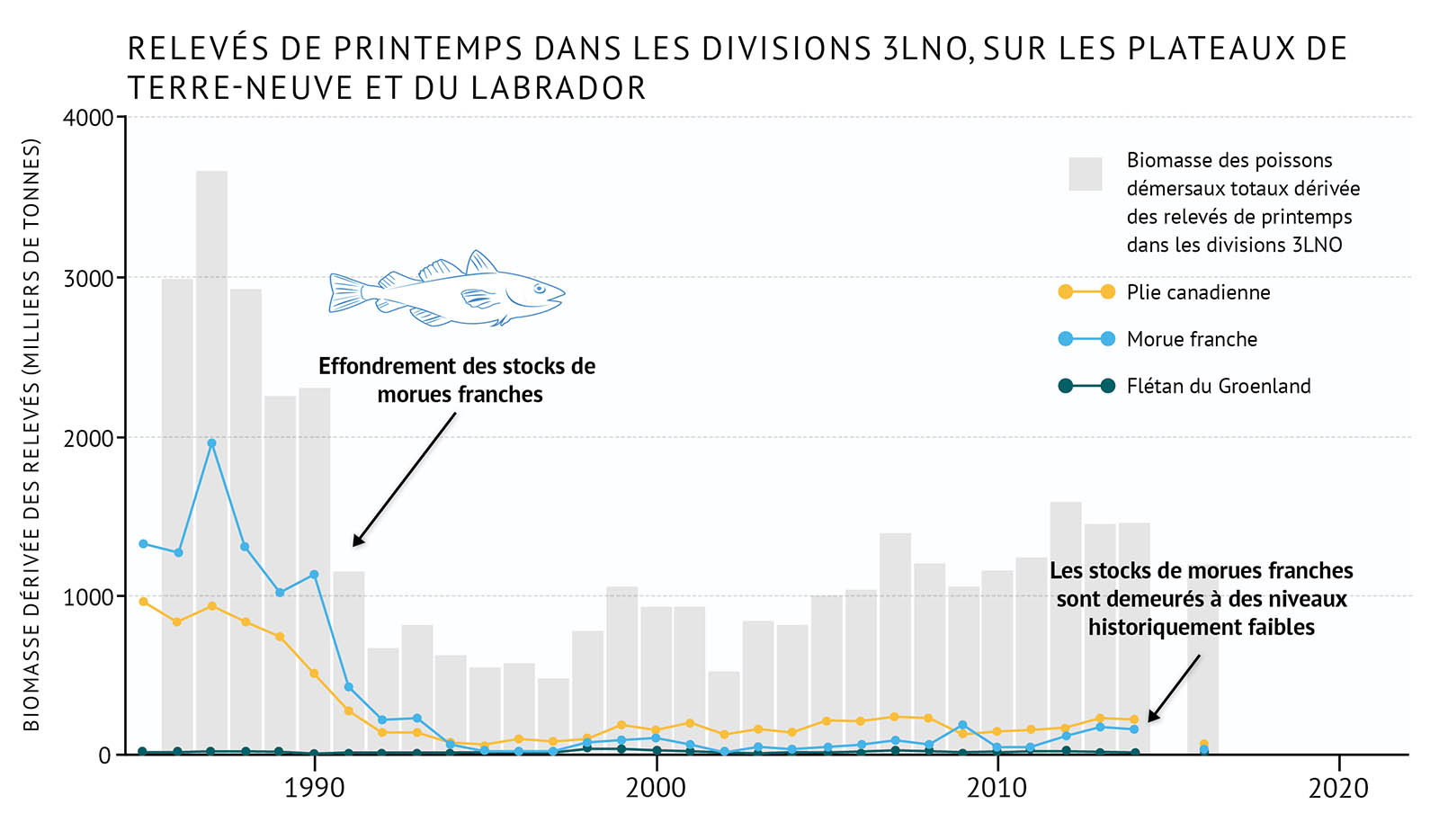
Figure 34 : Biomasse totale des espèces de poissons démersaux dérivée des relevés de printemps dans les divisions 3LNO, sur les plateaux de Terre-Neuve et du Labrador, de pair avec la biomasse d’espèces démersales individuelles.

Figure 35 : Biomasse du capelan dérivée des relevés acoustiques du printemps dans la division 3L, sur les plateaux de Terre-Neuve et du Labrador.

Figure 36 : Biomasse totale des espèces d’invertébrés benthiques dérivée des relevés d’automne dans les divisions 2J3K, sur les plateaux de Terre-Neuve et du Labrador, de pair avec la biomasse dérivée des relevés d’espèces d’invertébrés individuelles.
Mammifères marins

Figure 39 : Tendances actuelles affichées par les populations de mammifères marins dans l’Atlantique Nord-Ouest. Plusieurs sont inconnues.
On trouve environ 30 espèces de pinnipèdes (phoques et morses) et de cétacés (baleines, dauphins et marsouins) dans l’Atlantique Nord-Ouest. Plusieurs espèces de cétacés migrent en été, y compris le rorqual commun, le rorqual à bosse, le petit rorqual, plusieurs espèces de dauphins et la baleine noire de l’Atlantique Nord. On estime que ces espèces saisonnières donnent naissance et s’accouplent dans les zones tempérées et tropicales durant l’hiver. Elles se déplacent ensuite vers le nord pour s’alimenter dans les eaux de l’Atlantique canadien, et leurs sources de nourriture sont essentiellement le capelan, le hareng de l’Atlantique et le krill nordique. Certains mammifères marins qui fréquentent l’Atlantique peuvent également être observés dans l’Arctique. Cela comprend des espèces comme le béluga, le phoque annelé et le morse de l’Atlantique. Des espèces migratrices comme le phoque du Groenland et le phoque à capuchon passent une partie de l’année dans l’Arctique, mais se déplacent vers le sud pour donner naissance (mettre bas) et s’alimenter.
Le rôle des mammifères marins dans le réseau trophique de l’Atlantique varie de façon importante, allant des phoques gris se nourrissant de poissons jusqu’aux baleines noires de l’Atlantique Nord, qui se déplacent lentement et qui consomment des copépodes ainsi que des poissons. Comme bon nombre d’espèces de mammifères marins sont migratrices et très mobiles, leurs déplacements peuvent refléter des changements dans les proies ou les conditions environnementales.
L’estimation de la manière dont plusieurs mammifères marins vivent dans l’écosystème de l’Atlantique, y compris la manière dont ils se répartissent, leur emplacement et leur comportement, peut aider les chercheurs à mieux comprendre le milieu marin dans son ensemble. On surveille les déplacements et le comportement de plongée de certaines espèces qui ont été marquées en utilisant la télémétrie par satellite. Cela nous aide à mieux comprendre leur répartition saisonnière et leur utilisation de l’habitat. Pour plusieurs cétacés, les signalements et les déclarations occasionnelles des navigateurs et des observateurs sont les principaux indices de leur emplacement. Le premier relevé de grande ampleur des cétacés le long du plateau continental canadien a été mené en 2007. Les résultats d’un second relevé réalisé en 2016 nous aideront à mettre à jour ces estimations dans de futurs rapports.
État et tendances
- Notre compréhension des endroits où vivent les mammifères marins dans l’Atlantique varie de façon importante d’une espèce à l’autre. On ne dispose pas de données sur les effectifs et sur les tendances affichées par la taille des populations pour bon nombre d’espèces (figure 39).
- La diminution de la glace de mer a entraîné une mortalité accrue chez les phoques du Groenland, qui se reproduisent sur la glace.
- Certaines espèces pourraient profiter d’une diminution de la glace de mer. Par exemple, une diminution de la glace de mer peut réduire le nombre de rorquals bleus menacés d'être piégés dans la glace épaisse près des côtes. Au cours des années où la glace est abondante, ils peuvent être piégés et poussées sur le rivage tout en se nourrissant le long de la lisières de glace à l’embouchure du golfe du Saint-Laurent et le long de la côte sud-ouest de Terre-Neuve au début du printemps. En 2014, neuf rorquals bleus matures ont été tués le long de la côte sud-ouest de Terre-Neuve. La perte de l'étendue de la glace de mer et le déplacement des proies vers le nord ont déjà entraîné des changements dans la répartition des pinnipèdes et des cétacés très mobiles. Cela inclut des visites plus fréquentes d'épaulards dans les régions du nord de l'Atlantique.
- Avec la diminution de la glace de mer, la mise bas des phoques gris dans le golfe du Saint-Laurent, qui se déroulait presque complètement sur la banquise au début des années 1990, se produit maintenant virtuellement sur terre.
Tortues de mer

Figure 40 : Déplacement saisonnier de tortues luth dans les eaux canadiennes entre 1999 et 2016 d’après le suivi des animaux marqués par satellite. Les zones encerclées en orange représentent les zones fortement utilisées (plus de 50 % du temps).
Les tortues de mer les plus fréquemment rencontrées dans l’Atlantique canadien sont la tortue luth et la tortue caouanne. Les deux espèces sont migratrices, se déplaçant entre les plages, les eaux côtières près du rivage et les eaux libres durant différents stades de leur développement. Entre les mois de juin et de décembre, les tortues luth occupent habituellement l’Atlantique canadien, qui représente l’un de leurs habitats d’alimentation les plus importants (figure 40). Ces animaux fréquentent la zone ensoleillée de l’océan, passant la plupart de leur temps dans les eaux qui se trouvent près de la surface. Cela les rend vulnérables face aux activités de pêche, durant lesquelles elles sont capturées en tant que prises accessoires. On peut observer des tortues caouannes juvéniles principalement durant l’été et l’automne dans les eaux chaudes du large. La plupart des échouements de tortues caouannes se produisent à la fin de l’automne. Les échouements ont été associés à des températures océaniques ambiantes froides et au début de l’hypothermie.
Les œufs et les jeunes des tortues de mer sont soumis à de hauts taux de prédation dans les environnements aquatiques et terrestres, par un vaste éventail de prédateurs marins, y compris des oiseaux et des poissons. Ainsi, les tortues de mer transportent des éléments nutritifs et de l’énergie entre les écosystèmes marins et terrestres. Les tortues luth contribuent également à l’équilibre des écosystèmes dans certains secteurs, en consommant des scyphozoaires, qui sont des prédateurs importants de zooplancton et de poissons au stade larvaire.
Tous les ans depuis 2002, on a observé des tortues luth dans des zones d’alimentation fortement utilisées au large de la Nouvelle-Écosse. L’échantillonnage dans l’eau, la pose d’étiquettes d’identification et les études de télémétrie nous ont tous fourni des éclairages sur les caractéristiques de la population, les déplacements des animaux, leur comportement de recherche de nourriture et l’utilisation de l’habitat pour les tortues luth et les tortues caouannes.
État et tendances
- Les tortues luth et les tortues caouannes sont jugées en voie de disparition selon la Loi sur les espèces en péril fédérale.
- Les observations de tortues luth durant les études sur le milieu marin ou par des observateurs des pêches suggèrent que leur population dans les eaux de l’Atlantique canadien est stable.
- La répartition des tortues caouannes juvéniles dans l’Atlantique Nord-Ouest est limitée par la température de l’océan. La plupart des observations sont effectuées durant l’été et l’automne dans les eaux chaudes de mer ouverte, notamment celles sur lesquelles influe la bordure septentrionale du Gulf Stream.
- La densité saisonnière de la population de tortues de mer dans les eaux du Canada demeure inconnue pour toutes les espèces.
- Entre 1996 et 2006, on estime à 9 592 le nombre de tortues caouannes juvéniles qui ont été capturées de façon fortuite dans la pêche à la palangre de surface.
Oiseaux de mer

Figure 41 : Changement moyen en pourcentage de la taille des populations de 20 espèces d’oiseaux de mer nicheurs dans l’est du Canada depuis 1970 pour lesquels des données sont disponibles.

Figure 42 : Le nombre d’espèces d’oiseaux de mer (parmi les 20 espèces pour lesquels des données sont disponibles) qui a augmenté ou diminué depuis 1970.
Plus de 20 espèces différentes d’oiseaux de mer nichent sur le littoral de l’est du Canada. Un nombre supplémentaire de 40 espèces provenant de l’Arctique, d’Europe et même d’Amérique du Sud se nourrissent dans la région. Le nombre total de ces oiseaux est estimé à des dizaines de millions à certains moments de l’année.
Les oiseaux de mer constituent l’une des composantes les plus visibles des paysages marins. En tant que prédateurs de niveau trophique supérieur et excellents échantillonneurs du milieu marin, les oiseaux de mer peuvent jouer un rôle d’indicateurs efficaces de la santé globale de l’océan.
Les tendances affichées par la population d’oiseaux de mer sont mesurées grâce à des relevés systématiques. Ces relevés consistent à dénombrer tous les individus ou les nids de populations reproductrices entières à tous les sites ou à des sites clés sélectionnés. Ils prennent également la forme de relevés par parcelles qui permettent d’échantillonner une partie représentative de la colonie. Les relevés aériens représentent le moyen le plus rentable d’effectuer une estimation exhaustive de la population d’oiseaux de mer nichant au sol (par exemple, les goélands, les sternes et les fous de Bassan). Les relevés réalisés au sol sont nécessaires si l’on veut échantillonner les oiseaux de mer qui nichent dans des terriers ou dans des crevasses (comme les macareux moines et les océanites cul-blanc). Les oiseaux de mer qui nichent sur les falaises (comme les alcidés et les mouettes tridactyles) sont plus facilement dénombrés à partir de bateaux.
État et tendances
- La surveillance systématique des grandes colonies d’oiseaux de mer qui a été effectuée depuis les années 1970 montre que, dans l’ensemble, les populations d’oiseaux de mer nicheurs ont augmenté (figure 41, figure 42).
- Les populations des oiseaux de la famille des alcidés – guillemots marmettes et macareux moines de l’Atlantique, par exemple – ont connu une croissance importante, car peu de ces oiseaux ont été capturés dans les filets maillants depuis la fermeture de la pêche à la morue dans la plupart des zones en 1992.
- Les populations de fous de Bassan du nord ont également augmenté depuis que des restrictions ont été imposées quant à l’utilisation de pesticides en Amérique du Nord dans les années 1970. Cependant, ces populations se sont stabilisées au cours des dernières années. Cette situation s’explique en partie par les déclins dans l’abondance et les changements dans la répartition de poissons proies de grande qualité.
- Les populations d’espèces se nourrissant en surface, comme les goélands argentés et les mouettes tridactyles, ont diminué depuis le début des années 1990. Cela s’explique par des changements dans les conditions océanographiques qui ont une incidence sur la disponibilité des poissons proies. Cela résulte également de la diminution du nombre de poissons rejetés par les bateaux de pêche depuis le moratoire sur la pêche de la morue qui touche certaines espèces de poissons démersaux dans la plus grande partie de l’est du Canada.
- Une évaluation récente des perspectives de conservation de tous les oiseaux de mer a montré que la plupart des espèces suscitent des préoccupations en matière de conservation modestes. Cependant, ces oiseaux continuent d’être menacés par les activités continues de pêche commerciale et par l’exploration et la production du pétrole et du gaz. Heureusement, la pratique illégale du rejet d’hydrocarbures par les navires sillonnant l’océan le long de la côte atlantique a diminué au cours des 15 dernières années. C’est ce qu’indique le plus faible nombre d’oiseaux mazoutés observés le long des plages de Terre-Neuve et de la Nouvelle-Écosse.
Espèces aquatiques envahissantes
Les espèces aquatiques envahissantes (EAE) sont considérées comme étant des organismes qui entrent en compétition avec les espèces indigènes et qui s’établissent dans un nouvel environnement dépourvu de leurs prédateurs naturels. Cela favorise leur croissance ou leur reproduction rapide. Les EAE peuvent menacer les écosystèmes aquatiques en occupant des habitats d’espèces indigènes ou en entrant en compétition avec celles-ci. L’introduction et la propagation des EAE peuvent s’effectuer de façon naturelle par des larves ou des fragments dérivant dans les courants d’eau. Elles peuvent également s’effectuer par l’entremise d’activités humaines, y compris la navigation commerciale ou de plaisance, l’aquaculture et les activités de pêche, le commerce des animaux et des espèces destinées aux aquariums ou l’introduction intentionnelle. Certaines espèces d’ascidies (tuniciers non indigènes) et le crabe vert européen sont les espèces les plus prolifiques et perturbatrices parmi les envahisseurs non indigènes le long de la côte de l’Atlantique canadien.
L’effet négatif des espèces envahissantes sur les écosystèmes marins de l’Atlantique canadien comprennent des déclins dans l’abondance et la biomasse de communautés de poissons estuariennes, des déclins dans la biomasse de la zostère et du varech et des changements dans la structure des communautés de certains invertébrés benthiques. Les espèces envahissantes peuvent aussi avoir des conséquences négatives pour les industries de la pêche commerciale et de l’aquaculture.
Le Programme de monitorage des espèces aquatiques envahissantes de la zone Atlantique du MPO se sert de méthodes normalisées pour surveiller les espèces de biosalissures. Dans le cadre de ce programme, on mène des recherches sur les répercussions et sur les mesures d’atténuation des menaces posées par les EAE dans l’Atlantique.
État et tendances
- En 2017, onze EAE marines ont été reconnues comme présentant différents niveaux de répercussions négatives sur les écosystèmes marins de l’Atlantique canadien (selon le programme de monitorage des espèces aquatiques envahissantes de la zone Atlantique du MPO).
- Le réchauffement des eaux de l’Atlantique, qui est associé au changement climatique, peut faciliter encore davantage l’établissement et les effets subséquents des EAE sur les communautés marines de l’Atlantique.
Tout est interrelié
Les écosystèmes de l’océan Atlantique forment un réseau écologique complexe. Des liens sont tissés entre les composantes biologiques et les caractéristiques physiques et chimiques de l’environnement. Ce réseau océanique interconnecté exige que l’on réalise des études approfondies reposant sur des démarches écosystémiques pour mener à bien des programmes de recherche et de surveillance scientifiques.
Les interrelations entre les organismes et les processus qui se déroulent dans les écosystèmes de l’océan Atlantique sont en train de changer. Les changements sont à la fois d’origine naturelle et d’origine anthropique. Des changements réels se produisent dans les réseaux trophiques océaniques. Les types d’espèces, leur emplacement, leur habitat et leur régime alimentaire changent à différents rythmes et à différentes échelles parallèlement aux changements physiques du milieu marin.
Parmi ces changements figurent la hausse des températures de la surface de la mer, l’acidification de l’océan et les événements qui causent de l’hypoxie. Les changements comprennent aussi une augmentation de la biomasse de bon nombre d’espèces comme le homard d’Amérique, le flétan de l’Atlantique et les phoques. Des espèces d’eau chaude et des espèces aquatiques envahissantes arrivent, et d’autres espèces, comme la baleine noire de l’Atlantique Nord, voient leur répartition changer.
L’océan Atlantique du Canada affiche une perte de glace de mer ainsi que des déclins de l’abondance de la morue franche et du hareng. Certaines populations d’oiseaux de mer comme les goélands argentés et les mouettes tridactyles déclinent également. Les baleines noires de l’Atlantique Nord, les rorquals bleus, les tortues luth et les tortues caouannes, des espèces en voie de disparition, sont en difficulté. Certaines espèces se rétablissent et prospèrent. Il s’agit notamment de populations d’oiseaux de mer comme les guillemots marmettes et les macareux moines de l’Atlantique. Les conditions des habitats naturels évoluent en même temps que les changements dans les efflorescences de phytoplancton et dans la structure des communautés de zooplancton. Ces changements complexes sont tous interreliés. Il est essentiel que nous comprenions les incidences du changement climatique, des pressions d’origine anthropique et de la variabilité naturelle.
La surveillance et la recherche continues sur le milieu océanique et sur les organismes qui habitent les écosystèmes marins de l’Atlantique nous aideront à découvrir comment nos écosystèmes marins sont interreliés et comment ils changent. Cela nous aidera également à améliorer les mesures de gestion et de conservation.
- Date de modification :





